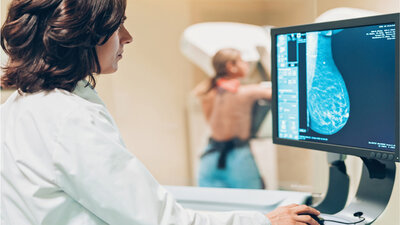
Brustkrebs (Mammakarzinom)
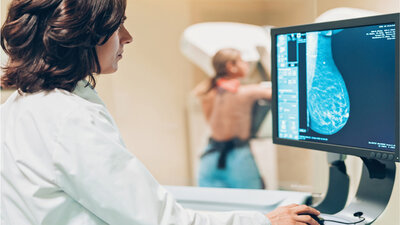
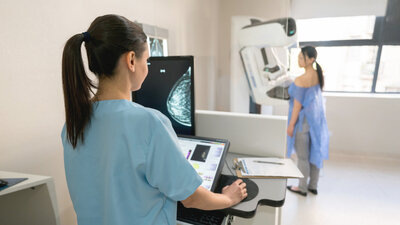
Die Mammographie hilft, Brustkrebs zu diganostizieren.
© Thinkstock/istockphoto
Überblick
In Deutschland erhalten jedes Jahr rund 70.000 Frauen[1] die Diagnose Brustkrebs. Brustkrebs ist damit die häufigste Krebserkrankung des weiblichen Geschlechtes. Statistisch gesehen erkrankt etwa jede achte Frau im Laufe ihres Lebens daran. Verbesserte Früherkennung und Therapie haben aber dafür gesorgt, dass immer mehr Frauen mit Brustkrebs geheilt werden können. Seit 1990 sinkt die Sterblichkeit durch die Erkrankung.
Kann man in jedem Alter Brustkrebs bekommen?
Brustkrebs kann auch schon bei jungen Frauen auftreten. Etwa 30 Prozent der Frauen sind bei ihrer Erkrankung jünger als 55 Jahre. Das Durchschnittsalter der Betroffenen liegt allerdings über 60 Jahre.
Wie hoch ist die Wahrscheinlichkeit, Brustkrebs zu überleben?
Vorab muss man sagen, dass die Erkrankung bei jeder Frau unterschiedlich verläuft und die Überlebensrate natürlich auch maßgeblich von verschiedenen Faktoren abhängig, beispielsweise der Bösartigkeit des Tumors und davon wie fortgeschritten er bei der Diagnose ist.
Insgesamt liegt die relative 5-Jahres-Überlebensrate von Brustkrebspatientinnen, über alle Erkrankungsstadien betrachtet, mittlerweile bei durchschnittlich 88 Prozent. Der Ausdruck "relative 5-Jahres-Überlebensrate" ist eine statistische Angabe, die häufig bei Krebserkrankungen angewendet wird. Sie besagt, wie viele Patienten von hundert Betroffenen fünf Jahre nach Feststellung der Diagnose leben, bezogen auf die im selben Zeitraum überlebende Allgemeinbevölkerung gleichen Alters und Geschlechts. Das bedeutet:
Die große Mehrheit (88 von 100) der von Brustkrebs betroffenen Frauen ist also fünf Jahre nach der Diagnose am Leben, auch zehn Jahre danach beträgt die relative Überlebensrate noch 83 Prozent.
Wovon hängt die Prognose ab?
Zunächst einmal gilt: Je früher Brustkrebs erkannt wird, desto besser sind im Allgemeinen die Heilungssaussichten. Entscheidend für die Prognose, also für den voraussichtlichen Verlauf der Erkrankung, ist neben der Tumorgröße und dem Ausbreitungsstadium der biologische Charakter des Krebses. Daraus lassen sich Rückschlüsse auf sein Wachstumsverhalten und die benötigte Behandlung der Betroffenen ziehen. Für die Therapiewahl werden die biologischen Einschätzungen der Erkrankung immer wichtiger. Aber auch ob zum Zeitpunkt der Diagnosestellung bereits Tochtergeschwülste (Metastasen) vorhanden sind, beeinflusst die Aussichten. Ebenso spielen das Alter der Patientin und Begleiterkrankungen bei der Prognose eine Rolle. Deshalb sind statistische Zahlen letztlich relativ und im Hinblick auf den individuellen Krankheitsverlauf stets mit Vorsicht zu betrachten.
Dieser Artikel enthält nur allgemeine Hinweise und darf nicht zur Selbstdiagnose oder -behandlung verwendet werden. Er kann einen Arztbesuch nicht ersetzen. Die Beantwortung individueller Fragen durch unsere Experten ist leider nicht möglich.
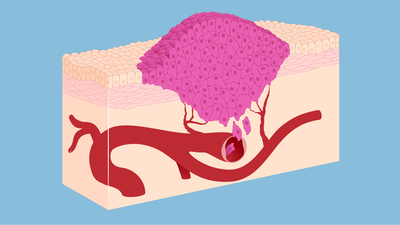
Mammakarzinom: Bösartiges Wachstum
Bei einem bösartigen Tumor der Brust verändern sich Zellen im Drüsengewebe grundlegend und können unkontrolliert und zerstörerisch in das umgebende Gewebe einwachsen. Ursache sind Schäden im Erbgut dieser Zellen.
Ausgangspunkt für den Tumoer sind entweder Zellen im Bereich eines Brustläppchens (lobulär) oder – häufiger – in einem Milchgang (duktal). Die weiblichen Geschlechtshormone – insbesondere Östrogene – fördern auch das Wachstum von hormonempfindlichen Brustkrebszellen.
Die Geschwulst wächst heran und kann als Knoten tastbar werden. Bösartige Zellen können über das Lymph- und Blutgefäßsystem auswandern, in andere Organe gelangen und dort Tochtergeschwülste (Metastasen) bilden.
Symptome: Anzeichen für Brustkrebs
In der Anfangsphase verursacht Brustkrebs meist keine Beschwerden. Mögliche Anzeichen, die auf Brustkrebs hindeuten können, sind:
- Knoten oder Verhärtungen in der Brust oder in der Achselhöhle
- eingezogene Brustwarze
- Austritt von blutiger Flüssigkeit aus der Brustwarze
- eine Brust verändert sich in Form und Größe im Vergleich zur anderen
- eingezogene Haut an der Brust (Apfelsinenhaut)
- Rötungen oder Schuppungen der Brusthaut, manchmal begleitet von Schmerzen, einem Ziehen in der Brust oder Schwellungen
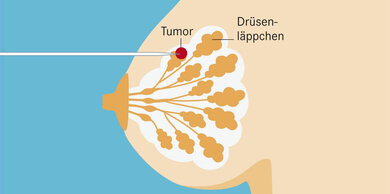
Schaubild der weiblichen Brust
© W&B/Martina Ibelherr
Verdächtiger Befund der Brust: Was macht der Arzt oder die Ärztin?
Beim Verdacht auf Brustkrebs veranlasst der Arzt oder die Ärztin weitere Untersuchungen, um den Befund abzuklären.
Frauen über 40
Üblicherweise ist die erste Untersuchung bei Frauen über 40 Jahren – falls noch nicht erfolgt – eine Mammografie. Ist das Brustdrüsengewebe sehr dicht und in der Mammographie nicht gut beurteilbar, kann ein Ultraschall der Brust die Untersuchung ergänzen. Sollte sich in der Mammografie und/oder im Ultraschall ein krebsverdächtiger Befund zeigen, ist anschließend eine Biopsie nötig.
Frauen unter 40
Bei Frauen unter 40 Jahren wird der Arzt die Brust in der Regel zunächst mit Ultraschall untersuchen. Bei einem verdächtigen Ultraschall-Befund schließt sich daran ebenfalls die Entnahme einer Gewebeprobe (Biopsie) an.
Weitere Untersuchungen
Kann der Krebsverdacht mit Hilfe von Mammographie und Ultraschall nicht ausgeräumt werden, können weitere Untersuchungsverfahren wie beispielsweise die Tomosynthese (3D-Mammographie) oder die Magnetresonanzsonografie (MRT) eingesetzt werden.
Bei einem nachgewiesenen Brustkrebs gehören eine Mammographie und die Ultraschalluntersuchung beider Brüste sowie der Lymphknoten der Achselhöhle zur Basisdiagnostik. Damit lässt sich feststellen, wie weit der Tumor sich lokal ausgebreitet hat und ob bereits Lymphknoten in der Achsel betroffen sein könnten.
Ein Computertomatogramm (CT) des Brust- und Bauchraums und eine Skelettszintigrafie kann notwendig sein bei
- Symptomen, die für das Vorliegen von Tochtergeschwülsten (Metastasen) sprechen, zum Beispiel Rückenschmerzen
- einem höheren Risiko für Tochtergeschwülste (Lymphknotenbefall, großer Tumor)
- einer aggressiven Tumorbiologie
Noch gutartig oder schon Krebs?
Ist der Befund unklar, ist eine Brustbiopsie notwendig, um herauszufinden, ob es sich um gut- oder bösartiges Gewebe handelt. Viele Frauen sind vorab bereits beunruhigt. Aber: Oft ist das Ergebnis gutartig. Auch sogenannter Mikrokalk entspricht häufig einem gutartigen Befund.
Manche gutartigen Veränderungen müssen allerdings trotzdem entfernt und / oder engmaschiger kontrolliert werden, da sie das Risiko für Brustkrebs erhöhen oder eine Krebsvorstufe darstellen können.
Absolut gutartig
Zu den eindeutig gutartigen Veränderungen, die sich nicht auf das Brustkrebsrisiko einer Frau auswirken, gehören beispielsweise einfache Fibroadenome. Sie treten bei Frauen vor den Wechseljahren relativ häufig auf.
Papillom
Papillome sind eigentlich gutartig: kleine, fingerförmige oder warzenartige, zudem gefäßreiche Wucherungen von Zellen, die das Milchgangssystem auskleiden. Das Papillom tritt aber manchmal zusammen mit anderen Gewebeveränderungen wie einer atypischen duktalen Hyperplasie (ADH) oder einem duktalen Carcinoma in situ (DCIS; siehe jeweils unten) auf, manchmal sogar mit einem invasiven Brustkrebs. Das zeigt sich teilweise erst, wenn das Gewebe vollständig entfernt wurde. Deshalb zählen Papillome heute zu den weiter unten beschriebenen "Gewebeveränderungen mit unsicherem biologischen Verhalten".
Papillome können einzeln auftreten (solitäres Papillom), etwa zentral in der Nähe der Brustwarze, in einem großen Milchgang. Dort können sie sich zum Beispiel mit blutigem Ausfluss aus der Brustwarze bemerkbar machen. Liegen sie weiter außen in der Brust, verteilen sie sich manchmal auch auf mehrere kleine Milchgänge und deren Endabschnitte (multiple Papillome). Sie lassen sie sich in der Regel nicht tasten und sind auch sonst symptomlos.
Kleine Papillome, die bereits mit der Biopsie vollständig entnommen werden können und die keine atypischen Zellen enthalten, erhöhen das Brustkrebsrisiko sehr wahrscheinlich nicht. Zur Kontrolle genügen dann meist die üblichen Screening-Mammografien. In anderen Fällen kann das Brustkrebsrisiko etwa zwei- bis dreifach erhöht sein. Das weitere Vorgehen ergibt sich aus dem Befund und in Absprache zwischen Arzt oder Ärztin und Patientin.
Veränderungen mit unsicherem Verhalten
Manche Gewebeveränderungen in der Brustdrüse werden im gegenwärtigen Stadium als noch gutartig eingestuft. Sie können sich aber unter bestimmten Bedingungen zu einem invasiven Brustkrebs weiterentwickeln. Generell kann man sagen, dass eine höhere Zellteilungsaktivität (Proliferation) und eine stärkere Abweichung (Atypie) der Zellen von ihrem "normalen" Erscheinungsbild mit einem erhöhten Brustkrebsrisiko einhergehen. Die Abweichungen oder Atypien können unterschiedlich stark sein. Bei einem duktalen Carcinoma in situ (DCIS) zum Beispiel ähneln die enthaltenen Zellen schon sehr stark Krebszellen (mehr dazu weiter unten).
Ein anderer Fachbegriff, der in diesem Zusammenhang häufiger vorkommt, lautet präinvasive Läsion. Er besagt, dass die Veränderung oder Wucherung (Läsion) zum gegenwärtigen Zeitpunkt noch nicht zerstörerisch in andere Gewebe einwächst, sondern noch innerhalb ihrer "natürlichen Grenzen" (in situ) bleibt. Sie kann sich aber zu einer invasiven Läsion, die in andere Gewebe einwächst, weiterentwickeln. Präinvasive Läsionen können damit direkte Vorstufen von invasivem Brustkrebs sein. Sie können aber auch ein generell erhöhtes Brustkrebsrisiko anzeigen.
Oftmals sind solche Befunde symptomlos, somit auch nicht tastbar. Beim Mammografie-Screening können sie jedoch auffallen. Manchmal zeigen sie sich auch nur zufällig in einer Gewebebiopsie.
Die präinvasiven Läsionen lassen sich in zwei Gruppen einteilen:
- solche, die von den Milchgängen der Brustdrüsen ausgehen (duktal) und
- solche, die in den Drüsenläppchen entstehen (lobulär)
Zu den duktalen Läsionen gehören
- die atypische duktale Hyperplasie (ADH) und
- das duktale Carcinoma in situ (DCIS)
Lobuläre präinvasive Läsionen sind:
- die atypische lobuläre Hyperplasie (ALH) und
- das lobuläre Carcinoma in situ (LN/LCIS).
Atypische duktale Hyperplasie (ADH):
Diese Zellwucherung erhöht das Risiko für Brustkrebs je nach Ausprägung etwa um das Drei- bis Fünffache für beide Brüste nach zehn Jahren. Ab einer Größe von zwei Millimetern wird eine ADH als niedrig-gradiges DCIS bewertet (siehe unten). Eine ADH gilt auch als mögliche Vorstufe von Brustkrebs. Sie sollte daher entfernt werden.
Flache epitheliale Atypie (FEA):
Eine der ADH nahestehende Veränderung ist die sogenannte flache epitheliale Atypie (FEA). Als Epithel bezeichnet man die Zellen, die Milchgänge und Drüsenläppchen auskleiden. Bei der FEA bilden sich hier neue, sehr flache Zelllagen. Eine FEA wird als früheste mögliche tumorartige Veränderung mit sehr geringem Entartungsrisiko eingeschätzt.
FEA müssen nur in besonderen Fällen entfernt werden (mehr dazu siehe Abschnitt "Nachsorge" am Ende dieses Kapitels). Häufig genügen die normalen Screening-Kontrollen alle zwei Jahre.
Lobuläre Neoplasien
Lobuläre Neoplasien (häufig werden hier auch die Abkürzungen LN oder LIN verwendet) bilden sich in den Drüsenläppchen oder in der Übergangszone zwischen Läppchen und Milchgang. Sie umfassen alle Varianten atypischer Epithelproliferationen von der atypischen lobulären Hyperplasie (ALH) bis zu deren ausgedehnter Form, dem lobulären Carcinoma in situ (LCIS oder CLIS).
In über der Hälfte der Fälle treten lobuläre Neoplasien an mehreren Stellen (multifokal) in der Brust auf, in einem Drittel in beiden Brüsten gleichzeitig. Das Risiko, ein invasives Karzinom zu entwickeln, ist bei diesen auch als "Risikoläsionen" für einen späteren Brustkrebs bezeichneten Veränderungen für beide Brüste erhöht. Es ist derzeit nicht ganz klar, ob es sich bei den LN um direkte Brustkrebsvorstufen handelt. Viele betroffene Frauen werden nicht an Brustkrebs erkranken. Ob Untersuchungen in engeren Abständen notwendig sind, legt der Arzt oder die Ärztin individuell fest.
Bei einer reinen, klassischen LN ist es normalerweise nicht notwendig, mehr Gewebe als bei der Biopsie aus der Brust zu entfernen, insbesondere nicht, wenn der in der Bildgebung aufgefallene Befund nach der Biopsie nicht mehr erkennbar ist. Manchmal können lobuläre Neoplasien aber sehr ausgeprägte Zellveränderungen enthalten. Mitunter treten sie auch zusammen mit einem DCIS oder mit einem invasiven Brustkrebs auf. Daher wird die betroffene Brust sorgfältig auf weitere Auffälligkeiten überprüft und verdächtige Bereiche werden gegebenenfalls entnommen.
© W&B/Martina Ibelherr
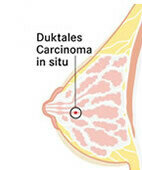
Duktales in-situ-Karzinom (DCIS)
Ein DCIS entsteht in Milchgängen und weist schon viele für Brustkrebs typische Veränderungen auf. Die enthaltenen, oft als bösartig beschriebenen Zellen haben aber nicht die Fähigkeit, über ihre natürlichen Gewebegrenzen hinaus in andere Gewebe zu "streuen", also Metastasen zu bilden.
Oft bildet sich ein DCIS zwar nur in einem Brustbereich (Quadrant), es kann jedoch dort mehrere Herde aufweisen. Der Fachbegriff dafür lautet multifokal. Andererseits kann es auch in mehr als einem Quadranten der Brust auftreten (multizentrisch). Und es kann, muss aber nicht tastbar sein. Häufig fallen DCIS durch kleine Kalkeinlagerungen (Mikrokalk) in der Mammografie auf. Die genaue Abgrenzung, ob nicht doch schon ein invasiver Krebs vorliegt, ist mitunter anhand der Biopsie schwierig, da sie immer nur einen kleinen Ausschnitt aus der Brust beziehungsweise aus der Gewebeveränderung widerspiegelt.
Beim DCIS gibt es Wucherungen mit niedrig-, mittel- oder hochgradig veränderten Zellen im pathologlogischen Befund. Zudem lassen sich – wie bei invasivem Brustkrebs – unterschiedliche biologische Eigenschaften erkennen. Diese finden auch Berücksichtigung bei der Therapieplanung, da ein DCIS inzwischen ähnlich behandelt wird wie ein die Gewebegrenzen überschreitender Brustkrebs.
Das Risiko für Brustkrebs ist bei einem DCIS noch höher als bei den zuvor genannten Veränderungen. Wie lange es dauert, bis aus einem DCIS ein invasiver Brustkrebs entsteht, ist aber unterschiedlich. Nach einer DCIS-Therapie sind auch Rückfälle (Rezidive) möglich – als DCIS oder auch als invasiver Brustkrebs. Dennoch: Die Prognose der betroffenen Patientinnen ist insgesamt sehr gut.
Da ein DCIS noch nicht über die natürlichen Grenzen hinaus in das umgebende Gewebe gewachsen ist, reicht hier meist eine weniger belastende Therapie aus. Vielfach kann der Arzt oder die Ärztin die Wucherung brusterhaltend operieren. Dabei entfernt er oder sie nur den betroffenen Teil der Brustdrüse plus zwei Millimeter gesundes Gewebe darum herum. In der Regel folgt dann eine Strahlentherapie.
Teilweise muss bei einem DCIS aber doch die ganze Brust abgenommen werden. Danach besteht die Möglichkeit, die Brust operativ neu aufzubauen.
Wichtig ist immer, dass der veränderte oder erkrankte Bereich vollständig entfernt wird. Falls das beim ersten Eingriff nicht der Fall ist, muss die Brust nachoperiert werden.
Nachsorge bei DCIS und Veränderungen mit unsicherem biologischen Verhalten
Nach der Entfernung einer präinvasiven Veränderung der Brust als auch nach Behandlung eines DCIS kann die Veränderung wiederkehren oder eine neue entstehen, bis hin zu einem Brustkrebs. Daher raten manche Experten den betroffenen Frauen in der Altersgruppe 50 bis 69 Jahre in den ersten fünf Jahren nach der Behandlung Nachsorgemaßnahmen in bestimmten Zeitabständen und ab dem sechsten Jahr Screening-Untersuchungen wahrzunehmen.
Bei einer FEA genügen die üblichen jährlichen ärztlichen Tastuntersuchungen in Verbindung mit der ärztlichen Beratung sowie die üblichen Screening-Mammografien alle zwei Jahre. Nach Behandlung einer ADH dagegen werden Kontrollmammografien alle zwölf Monate empfohlen.
Nach brusterhaltender Operation und Bestrahlung eines DCIS, ist eine ärztliche Tastuntersuchung der Brüste und das Beratungsgespräch mit der Patientin fünf Jahre lang alle sechs bis zwölf Monate vorgesehen, danach in jährlichen Abständen. Dasselbe gilt für eine entsprechend behandelte LN (LCIS). Kontrollmammografien und Sonografien beider Brüste werden Patientinnen mit DCIS / LN (LCIS) in jährlichen Abständen angeboten. Nach Mastektomie wird die verbliebene Brust in den selben Intervallen untersucht. Nur wenn sich neue Beschwerden oder Veränderungen im Brustbereich ergeben, sind weitere Untersuchungen angezeigt.
Formen und Einteilung von Brustkrebs
Wenn Brustkrebszellen zerstörerisch über die Gewebegrenzen hinweg in andere Bereiche hineinwachsen, handelt es sich um ein invasives Karzinom - also definitiv um Brustkrebs. Brustkrebs kann von den Zellen der Drüsenläppchen oder der Milchgänge ausgehen. Demnach unterscheidet man zwischen dem invasiven Läppchenkarzinom (lobuläres Karzinom) und dem häufigeren invasiven Karzinom ohne speziellen Zelltyp (no special type, NST). Letzteres wird oft auch als invasives duktales Karzinom bezeichnet.
Stadieneinteilung bei Brustkrebs
Ist die Diagnose Brustkrebs feingeweblich gesichert und die Lage des Tumors genau erfasst, können weitere Untersuchungen notwendig sein, um das genaue Erkrankungsstadium festzulegen. Dies ist wichtig für die weitere Therapieplanung.
Ist der Brustkrebs jedoch maximal fünf Zentimeter groß und sind die benachbarten Lymphknoten unauffällig, kann üblicherweise auf diese sogenannten Staginguntersuchungen verzichet werden, da die Wahrscheinlichkeit von Fernmetastasen in diesem Stadium gering ist.
Geht es jedoch darum, Fernmetastasen auszuschließen, wird ein Computertomogramm des Brust- und Bauchraumes sowie eine Knochenszintigraphie gemacht.
TNM-System
Liegen alle notwendigen Untersuchungen vor, wird die Brustkrebs-Erkrankung nach dem sogenannten TNM-System klassifiziert.
Die TNM-Klassifikation gibt Informationen über die Größe und Ausdehnung des Tumors (T), Zahl und Lage der befallenen Lymphknoten (N = node) und das Fehlen oder Vorhandensein von Metastasen (M). Vorangestellte oder hintangestellte Kürzel geben Zusatzinformationen.
Der vorangestellte Buchstabe p besagt, dass die Stadieneinteilung nach der Operation erfolgt ist und auf der Untersuchung des bei der Operation entfernten Gewebes durch den Pathologen basieren. Manchmal wird auch ein y vorangestellt. Das bedeutet, dass der Operation eine medikamentöse (systemische) Therapie vorausgegangen ist. Ein vorangestelltes c steht für ein durch die vorgenommenen Untersuchungen bestimmtes Tumorstadium.
Hier die verkürzte, auf die Tumorgröße bezogene T-Klassifikation:
- Tis: Carcinoma in situ, also noch nicht in die Umgebung einwachsender Krebs (siehe oben)
- T1mic: Geringfügig (0,1 cm) in die Umgebung eingewachsener Tumor (sogenannte Mikroinvasion)
- T1: Der Tumor hat eine Größe von maximal zwei Zentimetern
- T2: Der Tumor ist größer als zwei Zentimeter, aber maximal fünf Zentimeter groß
- T3: Der Tumor ist größer als fünf Zentimeter
- T4: Der Tumor ist in die Brustwand oder Haut eingewachsen
Hinsichtlich der Lymphknoten gibt es die Abstufung N0 bis N3, welche das Ausmaß der miterkrankten benachbarten (regionären) Lymphknoten beschreibt. N0 bedeutet: Die Lymphknoten sind nicht befallen. Wenn der Arzt zum Beispiel anhand der Tast- und Ultraschalluntersuchung der Achselhöhle keine Auffälligkeiten festgestellt hat, entspricht dies der klinischen Beurteilung cN0. Bestätigt der Pathologe, dass von dort entnommene Lymphknoten auch feingeweblich gesund sind, ist das ein pN0-Befund. Der Zusatz sn ordnet den Befund den Wächterlymphknoten zu, also zum Beispiel: pN0 (sn).
Werden keine Metastasen in anderen Organen festgestellt, dokumentiert der Arzt dies mit M0, andernfalls mit M1.
UICC-Einteilung in Stadien 0 bis IV
Eine weitere Einteilung führt die TNM-Stadien zu neuen Gruppierungen zusammen. Daraus ergeben sich dann Stadien von 0 bis IV. Diese sogenannte UICC-Einteilung der Internationalen Vereinigung gegen Krebs (Union for International Cancer Control, UICC) lautet folgendermaßen:
- Stadium 0: In-situ-Karzinom, keine befallenen Lymphknoten (N0), keine Metastasen (M0)
- Stadium IA: Tumor maximal zwei Zentimeter (T1), weder befallenen Lymphknoten (N0) noch Metastasen (M0)
- Stadium IB: Tumor maximal zwei Zentimeter (T0/T1), Mikrometastasen in den Lymphknoten (N1mi), keine Fernmetastasen (M0)
- Stadium IIA: Tumor maximal zwei Zentimeter (T0, T1) mit begrenztem Lymphknotenbefall (N1) und ohne Fernmetastasen oder Tumor größer als zwei aber maximal fünf Zentimeter (T2) mit begrenztem Lymphknotenbefall (N0) und ohne Fernmetastasen (M0)
- Stadium IIB: Tumor größer als zwei, aber maximal fünf Zentimeter (T2) mit begrenztem Lymphknotenbefall (N1) und ohne Fernmetastasen (M0) oder Tumor größer als fünf Zentimeter (T3) ohne Lymphknotenbefall (N0) und ohne Fernmetastasen (M0)
- Stadium IIIA: Tumore maximal fünf Zentimeter (T0,T1,T2) mit ausgedehnterem Lymphknotenbefall (N2) ohne Fernmetastasen (M0) oder Tumor größer als fünf Zentimeter (T3) mit begrenztem oder ausgedehnterem Lymphknotenbefall (N1/N2) ohne Fernmetastasen (M0)
- Stadium IIIB: Tumor jeder Größe mit Ausdehnung auf die Brustwand oder Haut (T4), aber ohne Fernmetastasen
- Stadium IIIC: Tumor jeder Größe mit Lymphknotenbefall auch der Axilla oder der Schlüsselbeinregion ohne Fernmetastasen (M0)
- Stadium IV: Fernmetastasen vorhanden
Das Tumorstadium beeinflusst maßgeblich die Therapie und die Prognose. Bei der Prognose und Therapie spielen allerdings noch weitere Aspekte eine Rolle, unter anderem das sogenannte Grading und das Vorliegen von bestimmten Geweberezeptoren.
Grading: Ausreifungsgrad und Schnelligkeit des Wachstums
Der Pathologe überprüft auch, wie stark sich Krebszellen im Aussehen und Wachstumsverhalten von normalen Brustdrüsenzellen unterscheiden. Dies wird mit dem Differenzierungsgrad (Ausreifungsgrad, Grading) beschrieben.
In das Grading gehen drei Faktoren ein:
- die Zellteilungsrate der Tumorzellen,
- das Aussehen der Tumorzellkerne verglichen mit normalen Zellkernen,
- und die Ausbildung von Gangstrukturen im Tumor verglichen mit normalen Drüsengewebe.
Es werden drei Grading-Stufen unterschieden: In G1 ähneln die Tumorzellen noch weitgehend den gesunden Zellen; sie sind "gut differenziert" und teilen sich eher langsam. Bei G3 weichen sie stark von ihrer ursprünglichen Gestalt ab und teilen sich schnell. G2 liegt dazwischen. Je höher das Grading, umso aggressiver wächst der Tumor.
Auskunft über die Wachstumsaktivität gibt auch das Ki-67-Antigen, welches der Pathologe durch spezielle Färbungen im Tumorgewebe darstellen kann. Ki-67 ist unter anderem ein wichtiger Faktor für die Prognose.
Rezeptoren-Bestimmung
Schließlich gilt es festzustellen, ob die Tumorzellen hormonempfindlich sind oder vermehrt ein Eiweiß namens HER2 auf ihrer Oberfläche tragen, denn das kann Auswirkungen auf die Behandlung haben. Um das zu ermitteln, wird Gewebe aus der Biopsie vom Pathologen auf das Vorhandensein von entsprechenden Bindungsstellen (Rezeptoren) für Hormone und auf den Rezeptor HER2 untersucht.
Hormonrezeptoren
Bei den Hormonrezeptoren geht es um solche für Östrogene (engl. Abkürzung: ER) und Progesteron (PgR oder PR). Progesteron wird auch als Gelbkörperhormon bezeichnet.
Das Wachstum von vielen Mammakarzinomen wird durch Östrogene gefördert. Wenn mindestens ein Prozent der Tumorzellkerne Hormonrezeptoren auf der Oberfläche tragen, gilt der Tumor als hormonempfindlich. Konsequenz: Es bietet sich eine Anti-Hormontherapie an, gewissermaßen eine Hormonentzugsbehandlung.
HER2-Rezeptor
Die Abkürzung HER2 steht für humaner epidermaler Wachstumsfaktor-Rezeptor 2. Wenn sich viele Rezeptoren dieser Art auf den Brustkrebszellen befinden, neigen diese dazu, sich schnell zu teilen und zu vermehren.
Ob die Zellen HER2-positiv sind oder nicht, ist für die spätere Therapie relevant: Im positiven Fall kommt eine Antikörper-Therapie infrage.
Ein Tumor ist HER2-positiv,
- wenn der Immunhistochemie-(IHC-)Test dreifach positiv ist (3+).
- wenn mit der sogenannten in-situ-Hybridisierung (FISH, CISH oder SISH) vermehrt HER2-Genkopien im Zellkern nachgewiesen werden. Eine in-situ Hybridisierung wird durchgeführt, wenn die IHC zweifach positiv (2+) ist. Die alleinige IHC-Untersuchung ist in diesen Fällen nicht ausreichend.
Ist der IHC-Test 0 oder nur einfach positiv (1+) oder der Tumor zweifach positiv (2+) und die in-situ-Hybridisierung negativ, gilt der Tumor als HER2-negativ und eine gegen HER2 gerichtete Therapie verspricht wenig Nutzen.
Brustkrebs ist nicht gleich Brustkrebs
Brustkrebs lässt sich inzwischen durch Analysen der Genaktivität in den Tumorzellen noch genauer einordnen. Ärzte sprechen auch von molekularen Subtypen und leiten daraus zunehmend Entscheidungen für die Therapie ab. Da die notwendigen molekularbiologischen Analysen in der Routinediagnostik zu aufwendig sind, wird in der Praxis meist eine vereinfachte Einteilung vorgenommen, die auf dem Nachweis von Östrogen-(ER) und Progesteronrezeptoren (PR), dem "Human Epidermal Growth Factor Receptor 2" (HER2) und Ki-67 beruht.
Mit diesen immunhistochemisch bestimmten Markern werden folgende Untergruppen charakterisiert, die sich hinsichtlich ihrer Genmuster, ihrer biologischen und klinischen Eigenschaften und somit auch in der Therapie unterscheiden:
- Luminal A-ähnlicher-Typ
- Luminal B-ähnlicher Typ (entweder HER2-negativ oder HER2-positiv)
- Nicht-luminal HER2-positiv
- Triple-negativ (HER2-negativ und Hormonrezeptor negativ)
Neue molekularbiologische Tests, sogenannte Genexpressionstests, können zumindest bei hormonrezeptorpositiven, HER2-negativem Brustkrebs ohne Befall der Lymphknoten Aufschluss darüber geben, ob eine betroffene Frau auch ohne Chemotherapie auskommen kann.
Behandlung: Überblick
Brustkrebszentren: Behandlung durch ein Team von Spezialisten
Brust(krebs)zentren sind von der Deutschen Krebsgesellschaft und der Deutschen Gesellschaft für Senologie anerkannte (zertifizierte) Kliniken zur Diagnose und Behandlung von Brustkrebs.
Sie erfüllen die Anforderungen an eine Brustkrebstherapie in vollem Umfang und sichern aufgrund ihrer medizinischen Ausstattung und Fachkunde die notwendige Behandlungsqualität. Die Krankenkassen haben strukturierte Behandlungsprogramme für chronische Erkrankungen wie Brustkrebs auf Basis der Leitlinien entwickelt.
In die Behandlung sind Experten und Expertinnen unterschiedliche Fachdisziplinen eingebunden, zum Beispiel aus der Frauenheilkunde, Onkologie, Chirurgie, Pathologie, Strahlentherapie. Sie stimmen sich untereinander ab (interdisziplinäre Konferenz, Tumor-Board am zertifizierten Brustzentrum) und besprechen die einzelnen Schritte mit der Patientin.
Die Wahl der Behandlung hängt unter anderem von der Art des Tumors, dem Stadium der Erkrankung, vom Alter der Patientin (vor oder nach den Wechseljahren) sowie davon ab, ob der Brustkrebs von weiblichen Geschlechtshormonen im Wachstum gefördert wird. Auch die Wachstumseigenschaften spielen eine wichtige Rolle. Leitlinien fassen den Stand des medizinischen Wissens zusammen und geben Ärztinnen und Ärzten eine wichtige Orientierungshilfe.
Die Krankenkassen bieten häufig spezielle Programme für Brustkrebspatientinnen an, sogenannte "Disease Management Programme (DMP)". Die Teilnahme daran ist freiwillig. Solche Programme zielen bei Brustkrebs darauf ab, die Behandlungsstandards zu gewährleisten und die Betroffenen auch in der Nachsorge nach der Erstbehandlung zu begleiten. Außerdem sollen sie dazu beitragen, dass die Frau in dieser kritischen Phase nicht alleine gelassen wird und die notwendige psychosoziale Unterstützung erfährt. Schließlich soll das Programm die Abstimmung der behandelnden Ärzte und Ärztinnen untereinander und mit dem Hausarzt oder der Hausärztin verbessern helfen.
Manche Patientinnen entscheiden sich auch für eine Behandlung im Rahmen von Studien. Damit einher geht eine engmaschigere Versorgung und Kontrolle. Zusätzlich haben die Teilnehmerinnen gegebenenfalls die Möglichkeit, im Rahmen einer klinischen Studie von einer neuen, innovativen Therapie zu profitieren. Die Teilnahme ist freiwillig und kann jederzeit beendet werden. Die Therapie wird dann in der für die entsprechende Erkrankungssituation üblichen Weise weitergeführt.
Man sollte sich aber vor einer Entscheidung für oder gegen die Teilnahme an einer Studie genau über die Bedingungen informieren. Im Allgemeinen stehen die betreuenden Ärzte und Ärztinnen am zuständigen zertifizierten Brustzentrum als Ansprechpartner zur Verfügung.
Sinnvoll ist es auf jeden Fall, die Behandlung in einem zertifizierten Brustkrebszentrum planen zu lassen.
Wie kann man Brustkrebs behandeln?
Es gibt mehrere Säulen, aus denen sich eine Brustkrebstherapie zusammensetzen kann:
- Operation
- Strahlentherapie
- Anti-Hormontherapie
- Chemotherapie
- Zielgerichtete Therapien, unter anderem die Behandlung mit Antikörpern oder die Immuntherapie
Lebensstil: Was kann ich selbst tun?
Brustkrebspatientinnen können mit ihrem Lebensstil dazu beitragen, die Behandlung zu unterstützen:
- Bewegen, wenn es möglich ist: 150 Minuten mittelschwere körperliche Aktivität oder 75 Minuten anstrengende körperliche Aktivität pro Woche wären gut. Es gibt Studien, die besagen, dass fünfmal die Woche dreißig Minuten Sport das Risiko für einen Rückfall senken können. Sport wirkt auch einem Fatigue-Syndrom entgegen. Krafttraining ist vor allem bei einer Chemo- oder Hormontherapie sowie bei Lymphödemen empfehlenswert.
- Sich gesund ernähren. Dazu die Vorgaben der deutschen Gesellschaft für Ernährung[2] beachten und zum Beispiel kein oder nur wenig (< 10 Gramm pro Tag) Alkohol konsumieren und auf eine ballaststoffreiche Kost (> 30 Gramm Ballaststoffe pro Tag) achten.
- Nicht rauchen.
- BMI normalisieren: Wer einen zu hohen Body-Mass-Index hat, sollte versuchen, abzunehmen. Dabei helfen ein Verzicht auf Lebensmittel und Getränke mit vielen Kalorien sowie körperliche Aktivität.
- Bei einem Diabetes: Auf gute Blutzuckerwerte achten!
Schmerztherapie
Wenn infolge des Tumorwachstums Schmerzen auftreten, kann heute eine sehr gezielt gestaltete Schmerztherapie helfen. In schweren Fällen wird ein Schmerztherapeut oder eine Schmerztherapeutin hinzugezogen.
Bei der Schmerztherapie kommen Medikamente oder schmerzstillende Eingriffe in Betracht. Eine ergänzende Begleittherapie, zum Beispiel mit Antidepressiva (Mitteln gegen Depressionen), kann die Wirkungen der Schmerzmittel unterstützen. Diese lassen sich dann niedriger dosieren, sodass auch weniger Nebenwirkungen auftreten.
Die Schmerztherapie ist umso effektiver, je besser sie auf den Bedarf und die Wünsche der Betroffenen und ihren Tagesablauf zugeschnitten ist. Der Zeitplan der Einnahme sollte unbedingt eingehalten werden. Der Arzt oder die Ärztin kann ihn aber jederzeit überprüfen und die Medikamente an eine veränderte Situation anpassen.
Bisphosphonate bei Brustkrebs
Bisphosphonate sind Medikamente, die in erster Linie zur Behandlung von Osteoporose (Knochenschwund) dienen, zusätzlich zu Vitamin D und Kalzium gemäß ärztlicher Anweisung. Sie spielen daher auch bei der Behandlung eines Knochenschwundes bei Patientinnen mit Brustkrebs eine wichtige Rolle: Eine Osteoporose kann sich beispielsweise als unerwünschte Wirkung der anti-hormonellen Brustkrebstherapie entwickeln. Bisphosphonate unterstützen die Vorbeugung und Therapie einer solchen Osteoporose.
Ein weiteres Einsatzgebiet von Bisphosphonaten in der Brustkrebstherapie sind Erkrankungen mit einem gesteigerten Knochenabbau oder erhöhtem Kalziumspiegel im Blut (Hyperkalzämie) im Rahmen einer Skelett-Metastasierung. In der Behandlung von Schmerzen, die durch Tumorherde im Knochen verursacht werden, zeigen sie ebenfalls eine gute Wirksamkeit.
Vor Therapiebeginn sollte der Zahnarzt oder die -ärztin die Zähne sorgfältig kontrollieren und eventuell notwendige Behandlungen vornehmen, da die Medikamente den Kieferknochen angreifen können (Kieferosteonekrose).
Alternative und ergänzende Therapien bei Brustkrebs
Generell gilt, dass aus wissenschaftlicher Sicht keine der alternativen Therapien die schulmedizinischen Standardverfahren bei Brustkrebs ersetzen kann und sollte. Für die meisten Ansätze liegen nur unzureichende wissenschaftliche Erkenntnisse vor. Eine ergänzende, komplementäre Therapie etwa mit pflanzlichen oder anderen Therapien, wird aber von vielen Behandlungszentren unterstützt und angeboten. Besprechen Sie auf jeden Fall mit Ihrem behandelnden Arzt oder der Ärztin, wenn sie komplementärmedizinische Verfahren verwenden wollen. Dies gilt auch für die Anwendung von sogenannten Nahrungsergänzungsmitteln. Es gibt Substanzen, die in Kombination mit den Medikamenten, die bei einer Brustkrebstherapie verwendet werden, zu Wechselwirkungen führen können. Wenn alternative Mittel und Medikamente der Krebstherapie zum Beispiel über denselben Weg in der Leber verstoffwechselt werden, kann sich die Wirkung der Medikamente verstärken oder vermindern. Zudem sind auch pflanzliche Mittel nicht nebenwirkungsfrei.
Psychische Krankheitsbewältigung
Die Konfrontation mit der Diagnose "Krebs", der "Sturz aus der Normalität", Tage voller Angst und Verzweiflung, das Gefühl, sich nicht mehr auf den eigenen Körper verlassen zu können, nervenaufreibendes Warten auf medizinische Befunde, Strapazen und Leiden der Therapie – das alles hinterlässt tiefe Spuren.
Viele Betroffene fühlen sich auch nach der Behandlung noch über lange Zeit unterschwellig "alarmiert". Es ist auch nicht immer einfach, das richtige Maß zwischen zu wenig und zu viel Achtsamkeit gegenüber dem eigenen Körper zu finden.
Gelingende Krankheitsverarbeitung braucht Zeit und verständnisvolle Begleitung im privaten und beruflichen Umfeld. Betroffene können sich auch extern Rat und Hilfe suchen. Kompetente Ansprechpartner in Brustzentren sind Psychoonkologen und -onkologinnen, die schwerpunktmäßig Krebspatienten psychologisch betreuen. Auch psychosoziale Krebsberatungsstellen und ambulant tätige Psychoonkologen und -onkologinnen bieten professionelle psychologische Hilfe an. Adressen und Links finden Sie beim Krebsinformationsdienst (KID) des Deutschen Krebsforschungszentrums.
Eine positive Lebenseinstellung, erfüllende Aufgaben und Interessen, das Gespräch in der Familie, mit dem Partner und mit Freunden, der Austausch mit anderen Betroffenen, eventuell auch in einer Selbsthilfegruppe vor Ort, Erleben von Solidarität und Hilfe, schließlich die Erfahrung der zurückgewonnen Körperkraft – alles dies stärkt auch die Psyche und hilft, die Krankheit zu akzeptieren und zu bewältigen.
Operative Entfernung des Tumors
Eine operative Entfernung des Tumors ist die Basis der Therapie bei örtlich begrenzt wachsendem Brustkrebs. Das bedeutet aber nicht zwangsläufig, dass die gesamte Brust entfernt werden muss (Mastektomie). Heutzutage lässt sich bei 70 bis 90 Prozent der Frauen mit Brustkrebs die Brust erhalten (brusterhaltende Operation, BET). Der Operateur oder die Operateurin markiert sowohl die Absetzungsränder als auch das ehemalige Tumorgebiet, damit für den Fall einer Nachoperation und bei der Bestrahlung für Orientierung gesorgt ist.
In der anschließenden mikroskopischen Kontrolle in der Pathologie sollten die Ränder des entfernten Gewebes tumorfrei sein. Der Arzt oder die Ärztin spricht dann auch von tumorfreien Schnitträndern oder einer pR0-Resektion. Das bedeutet, der Tumor wurde optisch und feingeweblich "im Gesunden" entfernt. Wenn in der Gewebeprobe unter dem Mikroskop Tumorzellen im Randbereich festgestellt werden, ist eine erneute Opertion (Nachresektion) notwendig, um die Tumorreste zu entfernen.
Wenn der Tumor an mehreren Stellen sitzt oder wenn er nicht im gesunden Gewebebereich herausgenommen werden konnte, auch nicht bei einer Nachoperation, entfernt der Arzt die gesamte Brust. Dabei bleiben die Brustwandmuskeln, die die Brustwand formen, insbesondere der große Brustmuskel, erhalten. Oft ist es auch möglich den Hautmantel und die Brustwarze zu erhalten und bereits in derselben Operation die Brustform mittels einer Prothese wieder aufzubauen (primäre Rekonstruktion).
Möchte eine Patientin die Brust wegen eines Karzinoms entfernen lassen, obwohl es möglich ist, sie bei der Operation zu erhalten, so respektieren Ärzte und Ärztinnen den Wunsch selbstverständlich.
Wächterlymphknoten der Brustdrüse (Schemazeichnung).
© W&B/Martina Ibelherr
Entfernung von Lymphknoten und Wächterlymphknoten
Das Brustgewebe ist reich an Lymphbahnen. Sie transportieren die sogenannte Lymphe, die Gewebeflüssigkeit, Fett, Eiweiß, Krankheitserreger und Zellmaterial enthält. Auf ihrem Weg passiert die Lymphe mehrere Lymphknoten. Diese sind eine Art Kontrollstationen des Immunsystems. Verdächtige Bestandteile der Lymphe werden hier von der Immunabwehr entschärft. Besonders in der Achselhöhle gibt es viele Lymphknoten, da wir uns gerade an Händen und Armen oft verletzen und so alle möglichen Keime und Fremdstoffe eindringen können. Daher ist an dieser Stelle eine hohe Abwehrhürde nötig.
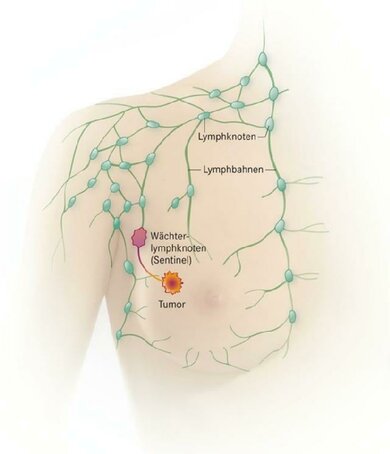
Vor allem eine Lymphknotenkategorie haben die Ärzte im Visier: den oder die sogenannten Wächterlymphknoten (Fachbegriff: Sentinel-Lymphknoten), die bei Brustkrebs oft in der Achselhöhle liegen. Das sind diejenigen, die der Lymphabfluss aus der Brustdrüse zunächst erreicht. Wenn ein Tumor in die Lymphbahn streut, sind die Wächterlymphknoten diejenigen, die in der Regel zuerst befallen sind.
Den Status der / des Wächterlymphknoten(s) zu kennen, ist bedeutsam für die noch genauere Stadieneinteilung der Krebserkrankung nach der Operation und für die weitere Therapieplanung. Sind noch keine Lymphknoten befallen, reicht in der Regel eine weniger eingreifende Therapie aus.
Vor der Operation oder auch vor einer neoadjuvanten Chemotherapie werden die Lymphknoten in der Achselhöhle durch Abtasten und eine Ultraschalluntersuchung überprüft. Ergeben sich dabei keine Auffälligkeiten, wird der Arzt in der Regel während der Brustoperation nach dem oder den Wächterlymphknoten suchen. Er kann sie mithilfe bestimmter Substanzen aufspüren, die er in die Umgebung des Tumors spritzt.
Dann entnimmt der Arzt den / die gesamten Wächterlymphknoten zur feingeweblichen Untersuchung (Sentinel-Lymphknotenexzision, SNE). Bei der Aufarbeitung des Gewebes durch den Pathologen wird definitiv geklärt, ob der Wächterlymphknoten tumorfrei ist. Ist der Lymphknoten befallen, kann es nötig sein, eine größere Zahl von Lymphknoten in der Achselhöhle zu entfernen (Lymphadenektomie oder Axilladissektion).
Ist kein Wächterlymphknoten auffindbar, kann das eine Axilladissektion ohne eine vorherige Entnahme von Sentinel-Lymphknoten notwendig machen.
Wiederaufbau der Brust
Wird viel Brustgewebe oder die gesamte Brust entfernt, so kann bereits während desselben Eingriffs mit dem Wiederaufbau der Brust begonnen werden (Sofortrekonstruktion). Der Wiederaufbau ist aber auch noch zu einem späteren Zeitpunkt möglich – als zweiter Eingriff nach der medikamentösen Behandlung und / oder der Strahlentherapie (Intervallrekonstruktion).
Aufbau mit einem Implantat
Entscheidet sich die Frau für ein Implantat, gibt es verschiedene Wege. Manchmal wird zunächst ein Expander eingesetzt. Das ist eine Silikonhülle, die schrittweise über ein Ventil von außen mit Kochsalz befüllt wird. Ist nach einigen Monaten die Haut ausreichend gedehnt, wird der Expander in einem zweiten Eingriff unter Vollnarkose durch das endgültige Implantat ("Silikongelkissen") ausgetauscht. Lässt sich ein ausreichend großer Hautmantel erhalten, um das Implantat aufzunehmen, kann es sofort eingesetzt werden (hautsparende Mastektomie, skin-sparing-Technik). Manchmal lässt sich auch die Brustwarze und der sie umgebende Warzenhof erhalten, zumindest anteilig (nipple-sparing-Technik): etwa wenn das direkt unter der Brustwarze liegende Gewebe tumorfrei ist und der Tumor weit genug entfernt lag.
Mögliche Probleme: Obwohl die Qualität der Implantate laufend verbessert wird, halten nicht alle dauerhaft. Ein Implantatbruch, zum Beispiel durch Einwirken äußerer Kräfte oder Materialermüdung, kann durchaus passieren. Letzteres ereignet sich mitunter unbemerkt. Verdächtige Symptome können Verformungen der Brust oder Schmerzen sein.
Dass sich mit der Zeit um die Prothese eine dünne Kapsel aus Bindegewebe bildet, ist eine normale Reaktion des Körpers. Bei einigen Frauen kann sich die Kapsel verdicken, eventuell sogar zusammenziehen (Kapselfibrose). Je nach Ausprägung ist das sicht- und tastbar, oft auch schmerzhaft. Die Brust kann härter werden und sich verformen, das Implantat sich verschieben.
Brustimplantate stehen im Verdacht in seltenen Fällen die Entstehung einer bestimmten Art von Blutkrebs, des anaplastischen großzelligen Lymphoms, zu fördern. Aktuelle Informationen zur Sicherheit von Brustimplantaten finden Sie beim Bundesinsitut für Arzneimittel und Medizinprodukte unter www.bfarm.de Stichwort „Brustimplantate“. (www.apotheken-umschau.de übernimmt keine Haftung und ist nicht verantwortlich für die Inhalte externer Internetseiten).
Der Arzt oder die Ärztin kontrolliert die Prothese in regelmäßigen Abständen. Falls es zwischenzeitlich zu Veränderungen und Beschwerden an der Brust kommt, sollte die Frau unverzüglich einen Termin vereinbaren, um die Ursache abzuklären. Gegebenenfalls ist eine operative Korrektur nötig, eventuell auch ein Austausch der Prothese.
Aufbau mit Eigengewebe
Es gibt auch die Möglichkeit, die Brust aus Eigengewebe zu rekonstruieren. Zum Beispiel aus Haut- und Fettgewebe – einem sogenannten "Gewebelappen" nebst Blutgefäßen – mit und ohne Muskelanteil. Für eine Rekonstruktion mit körpereigenem Gewebe kann dieses aus dem Bauch, Po, Rücken oder Oberschenkel entnommen werden. Statt eines Gewebelappens kann der Arzt oder die Ärztin in einigen Fällen auch Fettzellen aus dem Bauch, Beinen oder Po absaugen und verpflanzen (Lipofilling). Das ist jedoch eine längere Prozedur, bei der nach einer Vordehnung des Brusthautmantels in vielen Sitzungen über mehrere Monate hinweg kleine Portionen Fettgewebe versetzt werden, das dann Anschluss an Gefäße findet und einheilen kann.
Mögliche Probleme: Jede Operation hat ihre Risiken, so auch der Brustaufbau aus körpereigenem Gewebe. Er dauert länger als die Rekonstruktion mit einer Prothese und ist schon von daher belastender. Hinzu kommen die zusätzliche Wunde und der Gewebedefekt an der Entnahmestelle. Eigengewebe-Lappen – als sogenannte freie Transplantate ohne gefäßtragenden Gewebestiel –, müssen mikrochirurgisch, Gefäß für Gefäß, neu angeschlossen werden. Sie neigen eher zu Durchblutungsstörungen und Gewebeschäden als gestielte Transplantate, die an einem Gefäßbündel hängen und sich daher leichter am neuen Ort verankern lassen.
Bei den Operationstechniken gibt es verschiedene Varianten, die unterschiedlich aufwendig und ergiebig sind. Für den Wiederaufbau von kleinen Brüsten kommen andere Verfahren infrage als für den Aufbau großer Brüste. Zudem sind kombinierte Verfahren möglich, das heißt Prothese plus Eigengewebe.
Zu den möglichen Problemen bei beiden Verfahren gehören Nachblutungen, Ansammlungen von Wundsekret (Serom), Infektionen und Wundheilungsstörungen.
Anpassung der gesunden Brust
Die mittels Implantat rekonstruierte Brust ist fester und fällt nicht wie die gesunde Brust. Allerdings kann die Haut sich noch etwas dehnen. Eine mit Eigengewebe aufgebaute Brust senkt sich manchmal noch ab. Das heißt, bis das endgültige Ergebnis erreicht ist, dauert es immer ein paar Monate. Hat sich ein deutlicher Seitenunterschied ergeben, kann ein plastisch-chirurgischer Eingriff an der gesunden Brust die Symmetrie verbessern. Dabei kommt entweder eine Straffung (Mastopexie) oder Verkleinerung (Reduktionsplastik) oder aber eine Vergrößerung (Augmentation) in Betracht.
Aufbau von Brustwarze und Warzenhof
Auch die Brustwarze kann neu aufgebaut werden. Dies erfolgt aber erst, wenn die neu aufgebaute Brust völlig verheilt und eine Anpassungsoperation der gesunden Brust abgeschlossen ist. Die neue Brustwarze lässt sich aus einem Hautanteil der wiederhergestellten Brust oder aus Bauchhaut formen. Auch gibt es die Möglichkeit des "Nipple Sharing": Dabei entnimmt der Chirurg oder die Chirurgin einen kleinen Teil der gesunden Brustwarze und versetzt ihn auf die rekonstruierte Brust. Um den Warzenvorhof nachzubilden, stehen ebenfalls mehrere Möglichkeiten zur Verfügung: So kann ein Transplantat aus der etwas dunkler pigmentierten Haut der Leistengegend verwendet werden. Oder es erfolgt eine medizinische Tätowierung.
Komplikationen der Operation
Als mögliche Komplikation kann es bei einer Operation unter anderem zu Blutungen, Entzündungen oder Wundheilungsstörungen kommen.
Manchmal entwickelt sich früher oder später nach der Entfernung der Achsellymphknoten ein sogenanntes Lymphödem am Arm. Dabei kann die Lymphflüssigkeit nicht richtig abfließen, der Arm wird dick. Ursache dafür kann sein, wenn der Lymphabfluss nach der Entfernung von Lymphknoten in der Achsel gestört ist. Weil heute zunehmend schonend operiert und wenn möglich auf die Entfernung der Achsellymphknoten (Axilladissektion) verzichtet wird, ist die entsprechende Gefahr nicht mehr so groß.
Im zertifizierten Brustzentrum erhalten die Patientinnen viele Tipps und Informationen zur Vorbeugung eines Lymphödems.
Wichtig: Gemäßigte sportliche Aktivität, auch zum Beispiel Tennis, ist nach einiger Zeit durchaus erlaubt. Ein moderates Training der Armmuskulatur wirkt sich auf Schwellungen günstiger aus als Schonung. Bereits in der Klinik wird vorbeugend behutsam mit einer Übungsbehandlung für Arme und Schultern begonnen, um die Durchblutung und den Lymphfluss zu verbessern und Verspannungen zu lösen. Solche Übungen sind eigentlich immer ein guter Begleiter im Alltag, sie sollten unbedingt zuhause fortgeführt werden.
Manche Frauen kontrollieren in gewissen Abständen den Umfang des Ober- und Unterarmes (stets an denselben Stellen messen!), um eine Schwellung rechtzeitig zu erkennen. Symptome, die auf ein beginnendes Lymphödem hinweisen, können Schweregefühl oder Kribbeln im Arm, Schmerzen in der Achselhöhle und Anschwellen des Armes und der Finger bei Belastungen sein. Bei den ersten Anzeichen sollte die Betroffene zum Arzt gehen. Er wird die Ursache überprüfen und eine Behandlung einleiten.
Strahlentherapie
Die Bestrahlung (Radiatio oder Radiotherapie) bei Brustkrebs hat zum Ziel, Krebszellen mit hochenergetischen Strahlen zu zerstören. Die Strahlen werden so gezielt wie möglich eingesetzt, um umgebendes Gewebe und benachbarte Organe so weit wie möglich zu schonen.
Eine Bestrahlung ist bei Brustkrebs vor allem dann notwendig, wenn
- brusterhaltend behandelt wurde
- nach Mastektomie bei großen Tumoren im Stadium T3 oder T4 und bei weiteren Risikofaktoren
- das Tumorgewebe nicht vollständig entfernt werden konnte
- eine Operation nicht möglich ist
Nach einer brusterhaltenden Operation folgt üblicherweise eine adjuvante Radiotherapie. Eventuell noch verbliebene Krebszellen sollen damit vernichtet werden. Erwiesen ist, dass dadurch das Risiko für das örtliche Wiederauftreten des Tumors gesenkt und so die Überlebenschancen verbessert werden können.
Ablauf der Bestrahlung
Die Strahlentherapie beginnt in der Regel einige Wochen nach der Operation, wenn die Operationswunde gut verheilt ist, oder aber im Anschluss an eine adjuvante Chemotherapie. Über den optimalen Ablauf berät der Arzt oder die Ärztin die Betroffenen. Er wird die Bestrahlung erst dann beginnen, wenn es ohne Risiko für örtliche Komplikationen an der Brust geht.
Eine Anti-Hormontherapie wie auch die Behandlung mit einem HER2-Antikörper (siehe weiter unten) kann gleichzeitig mit der Strahlentherapie erfolgen. Ist eine Chemotherapie geplant, so findet die Bestrahlung meist erst danach statt.
Nach brusterhaltender Therapie wird in der Regel die gesamte Brust bestrahlt. Zusätzlich wird das "Tumorbett" häufig noch extra bestrahlt (engl. boost, Schub). In der Summe lässt sich so das örtliche Rückfallrisiko deutlich senken.
Hypofraktionierte Bestrahlung
Ist keine gezielte Bestrahlung der Lymphabflusswege notwendig, empfehlen Strahlenmediziner und -medizinerinnen heute nach brusterhaltender Operation meist eine hypofraktionierte Bestrahlung der operierten Brust. Pro Bestrahlungstermin werden dabei etwas höhere Einzeldosen (über zwei Gray) verabreicht, so dass sich die Gesamtdauer der Strahlentherapie verkürzt. Die Gesamtstrahlendosis ist mit etwa 40 Gray (Gy) insgesamt etwa niedriger als bei der früher üblichen konventionell fraktionierten Strahlentherapie. Zusätzlich wird das "Tumorbett", also die Stelle an der der Tumor saß, häufig noch gezielt bestrahlt ("Boost-Bestrahlung").
Konventionelle fraktionierte ("normofraktionierte") Bestrahlung
Nach Entfernung der ganzen Brust (Mastektomie) wird die Brustwand in der Regel mit Einzeldosen von 1,8 bis 2,0 Gy bis zu einer Gesamtdosis von rund 50 Gy bestrahlt (konventionell fraktionierte Bestrahlung).
Intraoperative Bestrahlung
Möglich ist die Bestrahlung aber auch schon während der Operation: Gleich nachdem der Tumor entfernt worden ist, wird eine Strahlenquelle in die Wundhöhle gelegt. Sie gibt, je nach eingesetzter Technik, über bis zu 30 Minuten Strahlung ab. Die intraoperative Strahlentherapie kann die postoperative Boost-Bestrahlung nach brusterhaltender Therapie vorwegnehmen, wodurch sich die Therapiedauer insgesamt verkürzt. Als alleinige Strahlentherapie gilt die intraoperative Strahlentherapie in den meisten Fällen nicht als ausreichend.
Teilbestrahlung der Brust
Bei der Teilbestrahlung der Brust (Partialbrustbestrahlung) wird nicht die ganze Brust bestrahlt, sondern nur die Region in der der Tumor lag. Sie kommt vor allem bei Frauen mit einem sehr niedrigen Rückfallrisiko infrage oder dann, wenn andere Gründe gegen eine Bestrahlung der kompletten Brust sprechen.
Nebenwirkungen der Strahlentherapie
Eine Strahlentherapie kann verschiedene Nebenwirkungen haben. So wird nicht nur das kranke, sondern auch das gesunde Gewebe durch die Strahlen beschädigt. Im Strahlenfeld liegende Organe, wie zum Beispiel Lungen und Herz, werden bei der Bestrahlung so gut es geht geschützt, um Schädigungen wie etwa Gewebeverhärtungen (Fibrosierungen) zu vermeiden. An der Haut kann es zu Reizungen und Verfärbungen kommen. Durch Bestrahlung der Achselhöhle kann dort beispielsweise Haarausfall auftreten. Manche Patientinnen leiden auch unter ständiger Müdigkeit und Erschöpfung (Fatigue).
Mehr Informationen zu Nebenwirkungen der Strahlentherapie
Antihormonelle Therapie
Viele Brustkrebsformen sind hormonempfindlich. Das bedeutet, dass diese Tumoren von den weiblichen Geschlechtshormonen zum Wachstum angeregt werden. Weisen die Brustkrebszellen Empfangsstellen für die Hormone, sogenannte Hormonrezeptoren auf, wird der Tumor hormonrezeptorpositiv genannt. Hier empfiehlt sich in aller Regel eine Anti-Hormontherapie.
Häufig kommt diese Therapie adjuvant, also nach der Operation zum Einsatz. Manchmal kommt eine Anti-Hormontherapie auch vor der Operation, also neoadjuvant, in Betracht.
Ob ein Tumor Hormonrezeptoren besitzt, zeigt die Gewebeuntersuchung. ER+ steht für Östrogenrezeptor-positiv und PgR+ oder PR+ für Progesteronrezeptor-positiv.
Prinzipiell kann eine antihormonelle Behandlung auf zwei Weisen gestaltet werden: Entweder wird die Bildung von Geschlechtshormonen unterbunden. Während dazu früher häufig Eierstöcke entfernt oder bestrahlt wurden, gibt es inzwischen Arzneimittel, die die Freisetzung der weiblichen Geschlechtshormone verringern. Oder aber die betroffenen Frauen bekommen Medikamente, welche an die Hormonrezeptoren der Tumorzellen binden und diese blockieren. Die Hormone können in beiden Fällen nicht mehr als Wachstumsreiz auf den Tumor wirken.
Antihormonelle Behandlung vor den Wechseljahren
Die Anti-Hormontherapie findet in der Regel nach der Operation statt, also adjuvant. Frauen vor den Wechseljahren bekommen normalerweise mindestens fünf Jahre lang das Medikament Tamoxifen. Tamoxifen ist ein sogenannter selektiver Östrogen-Rezeptor-Modulator (SERM). Es besetzt die Östrogen-Rezeptoren, ohne an den Brustzellen wie das Geschlechtshormon zu wirken. An manchen anderen Geweben wirkt es dagegen östrogenartig. Bei erhöhtem Rückfallrisiko kann die Therapie auf zehn Jahre ausgedehnt werden.
Bei erhöhtem Rückfallrisiko besteht zusätzlich die Möglichkeit, die Eierstöcke – und damit auch die körpereigene Östrogenproduktion – durch die Gabe sogenannter GnRH-Agonisten künstlich auszuschalten. GnRH-Agonisten, die auch GnRH-Analoga heißen, sind dem körpereigenen Neurohormon GnRH (Gonadotropin-Releasing-Hormon) ähnlich, das im Gehirn gebildet wird. Zu Beginn der Behandlung mit GnRH-Agonisten steigen die Östrogenspiegel kurzfristig an. Dann kommt die Hormonbildung in den Eierstöcken zum Erliegen, der Östrogenspiegel sinkt auf ein sehr nidriges Niveau ab und die hormonellen Wachstumsimpulse an die Krebszellen entfallen.
GnRH-Analoga werden in der Regel monatlich als Spritzen unter die Haut oder als Implantat alle drei Monate eingesetzt. Nach Beendigung der Therapie, die normalerweise zwei bis fünf Jahre dauert, können die Eierstöcke theoretisch wieder ihre Arbeit aufnehmen. Aromatasehemmer können vor den Wechseljahren nicht als alleinige Therapie eingesetzt werden, weil sie die Hormonproduktion in den Eierstöcken nicht immer vollständig unterdrücken.
Antihormonelle Behandlung nach den Wechseljahren
Nach den Wechseljahren kommt eine weitere Gruppe von Medikamenten mit antihormoneller Wirkung zum Einsatz: die sogenannten Aromatasehemmer. Aromatasehemmer können vor oder nach einer Therapie mit Tamoxifen oder auch alleine gegeben werden. Sie blockieren das Enzym Aromatase, das für die Herstellung von Östrogen im Körper notwendig ist. Zum Einsatz kommt die sogenannte dritte Generation an Aromatasehemmern:
- Anastrozol,
- Exemestan
- oder Letrozol.
Der Aromatasehemmer kann für fünf Jahre eingenommen werden. Oder er folgt auf zwei bis drei Jahre mit Tamoxifen, das dann für weitere zwei bis drei Jahre durch den Aromatasehemmer ersetzt wird (sogenannter "Switch"). Umgekehrt, also erst eine Behandlung mit dem Aromatasehemmer und dann mit Tamoxifen ist auch möglich. Die Gesamtdauer dieser aufeinanderfolgenden Therapie liegt ebenfalls bei fünf Jahren. Bei Patientinnen mit erhöhtem Risiko kann die Therapie mit einem Aromatasehemmer auf bis zu zehn Jahre verlängert werden. Ein Aromatasehemmer kann auch nach einer fünfjährigen Therapie mit Tamoxifen für weitere drei bis fünf Jahre gegeben werden. Dadurch verlängert ("erweitert") sich die Therapiedauer auf insgesamt acht bis zehn Jahre.
Nebenwirkungen der Anti-Hormontherapie
Unter einer antihormonellen Therapie treten als Nebenwirkungen häufig Östrogenmangelerscheinungen auf, wie sie auch in den Wechseljahren auftreten. Bei Frauen vor den Wechseljahren können Zyklusveränderungen auftreten.
Beispiele für Beschwerden, die unter einer Anti-Hormontherapie auftreten können:
- Tamoxifen: Unter anderem Hitzewallungen, Gerinnselbildungen in den Venen (Venenthrombosen), Lungenembolien und Schlaganfälle. Tritt eine Sehstörung auf, müssen die Augen unverzüglich untersucht werden. Auch sonst sind regelmäßige augenärztlicher Kontrollen bei einer Tamoxifen-Behandlung anzuraten.
- GnRH-Agonisten: Unter anderem Gelenk- und Muskelschmerzen, außerdem sinkt oft die Knochendichte. Nach Ende der Therapie holen die Knochen den Verlust an Dichte meist wieder auf, zumindest teilweise.
- Aromatasehemmer: Unter anderem Gelenk- und Muskelschmerzen, depressive Verstimmungen. Osteoporose kann ebenfalls auftreten.
Chemotherapie
Bei Brustkrebs kann zusätzlich zur Operation eine Chemotherapie nötig sein, um die Tumorzellen intensiv zu bekämpfen. Durch die Chemotherapie kann das Risiko der Wiederkehr des Tumors (Rückfall) und einer Metastasierung maßgeblich gesenkt werden. Der Nutzen einer Chemotherapie ist umso größer, je höher das Rückfallrisiko einer Frau ist. Insbesondere wenn das Risiko sehr hoch ist, dass der Brustkrebs wiederkehrt, sollten Frauen daher eine Chemotherapie erhalten.
Das Rückfallrisiko kann zum Beispiel in folgenden Situationen erhöht sein:
- Wenn eine Frau im Alter unter 35 Jahren erkrankt ist
- Falls ein HER2-positiver Tumor vorliegt
- Bei rezeptornegativem Brustkrebs
- Bei Krebs mit erkrankten Achsellymphknoten
- Bei einem Tumorgrad 3 (Grading G3), vermutlich auch ab Grad 2 (Grading G2)
- Bei Vorhandensein von Ki67 auf mehr als 20 bis 30 Prozent der Zellen.
Die Chemotherapie kann nach der Operation, also adjuvant, erfolgen. Wenn die Chemotherapie der Operation vorangestellt wird, wird sie als neoadjuvante Chemotherapie bezeichnet.
Die neoadjuvante oder präoperative Chemotherapie gilt heute als der adjuvanten Chemotherapie gleichwertig. Manche Expertengruppen empfehlen sogar, sie bevorzugt einzusetzen. Der Tumor kann dadurch maßgeblich verkleinert und operierbar gemacht werden, oft auch so weit, dass der Betroffenen die Entfernung der Brust erspart bleibt. Außerdem lässt sich auf diese Weise das Ansprechen des Tumors auf die Chemotherapie überprüfen.
Auch bei einer neoadjuvanten Behandlung werden – neuerdings oft erst nach der Therapie – Achsellymphknoten untersucht (Sentinel-Lymphknotenexzision oder Entnahme mehrerer Achsellymphknoten = Axilladissektion).
Manchmal ist es selbst für erfahrene Ärzte und Ärztinnen schwierig, einzuschätzen, ob eine Frau von einer Chemotherapie profitiert oder nicht. Neue molekularbiologische Tests, sogenannte Multigentests, können dann manchmal weiterhelfen. Zumindest bei hormonrezeptor-positiven, HER2-negativem Brustkrebs ohne Befall der Lymphknoten übernehmen die Krankenkassen die Kosten für diese Tests. Erkundigen Sie sich aber vorab!
Welche Medikamente kommen infrage?
In der Chemotherapie kommen Substanzen zum Einsatz, die die Zellteilung hemmen und die Krebszellen zerstören: Zytostatika, auch Chemotherapeutika genannt. Als systemische Therapie zielt die Chemotherapie auch auf Krebszellen, die möglicherweise außerhalb der Brust im Körper verstreut sind. Bei Brustkrebs werden bevorzugt sogenannte Anthrazykline wie Epirubicin oder Doxorubicin (auch Adriamycin genannt) und Taxane (Paclitaxel, Docetaxel) in unterschiedlichen Kombinationen angewandt.
Wie läuft die Chemotherapie ab?
Zytostatika werden oft als Infusion in die Vene, seltener als Tablette verabreicht. Die Chemotherapie erfolgt in Zyklen mit Pausen dazwischen, zum Beispiel alle drei Wochen, insgesamt vier bis sechsmal, manchmal sogar bis zwölfmal. Paclitaxel wird wöchentlich verabreicht. Die Therapie dauert normalerweise insgesamt etwa 12 bis 24 Wochen.
Bei jedem Zyklus wird die festgelegte Medikamentenkombination oder ein einzelnes Chemotherapeutikum gegeben. Nach einigen Zyklen kann sie von einer neuen Kombination abgelöst werden. Die Ärzte und Ärztinnen greifen hier auf bestimmte Abfolgen zurück, die in Studien umfassend geprüft wurden oder noch werden.
Wie viele Zyklen welcher Medikamente bei Brustkrebs nötig sind und ob die Chemotherapie ambulant oder stationär durchgeführt wird, richtet sich vor allem nach dem Gesundheitszustand der Patientin, der Ausprägung der Erkrankung und dem daraufhin ausgewählten Therapieschema. Heute können aber die meisten Therapien und die Zwischenkontrollen ambulant ablaufen.
Nebenwirkungen der Chemotherapie
Die Chemotherapie kann bekanntlich unangenehme Beschwerden verursachen, etwa Haarausfall, Schleimhautentzündungen, Appetitlosigkeit, Übelkeit und Erbrechen, Durchfall, Blutarmut, Abgeschlagenheit und Müdigkeit (Fatigue). Eventuell treten auch Nervenstörungen wie Kribbeln und Taubheitsgefühl oder Haut- und Nagelveränderungen auf. Mitunter sind Herzschäden und allergische Reaktionen möglich.
Allerdings gibt es Medikamente und Maßnahmen, die dazu beitragen, viele diese Nebenwirkungen abzumildern oder sogar ganz zu vermeiden. Sie werden zum Teil auch vorbeugend eingesetzt. Wenn dennoch Nebenwirkungen auftreten, sollte man daher mit dem behandelnden Arzt oder der Ärztin sprechen, was sich dagegen tun lässt. Auch die Apotheke kann manchmal mit Tipps weiterhelfen. Die Mehrzahl der Beschwerden geht nach der Behandlung innderhalb eines Jahres zurück, die meisten Betroffenen fühlen sich bald wieder besser.
Zielgerichtete Therapie
Bei etwa jeder fünften Patientin mit Brustkrebs bilden die Tumorzellen besonders viele HER2-Eiweiße an ihrer Oberfläche: Der Tumor ist HER2-positiv. Mit Medikamenten, die sich gegen den HER2-Rezeptor richten, lässt sich dann gezielt eingreifen. Trastuzumab ist das schon am längsten bei Brustkrebs angewandte Medikament aus der vergleichsweise neuen Gruppe zielgerichteter Arzneistoffe.
Diese zielgerichteten Medikamente können - in der Regel parallel zur Chemotherapie – in verschiedenen Phasen der frühen Behandlung gegeben werden: entweder zunächst vor der Brustoperation, also neoadjuvant oder nach der Operation, also adjuvant.
Es hat sich herausgestellt, dass bei HER2-positiven Patientinnen eine neoadjuvante Behandlung mit Trastuzumab und Pertuzumab sowie eine Chemotherapie den Tumor in der Erstbehandlung sogar komplett zum Verschwinden bringen kann. Dies zeigt sich dann am Operationspräparat (Fachbegriff: pathologische Komplettremission, kurz pCR).
Je nach Ergebnis wird die Antikörper-Therapie nach der Operation bis zu einer Therapiedauer von einem Jahr fortgesetzt werden. Sie kann alle drei Wochen als Injektion unter die Haut verabreicht werden.
Nebenwirkungen der zielgerichteten Therapie
Auch bei der zielgerichteten Therapie können Nebenwirkungen auftreten. Bei Trastuzumab zum Beispiel Herzprobleme, Kopfschmerzen oder Durchfälle.
Behandlung von Brustkrebs mit Fernmetastasen
Fernmetastasen sind Tochtergeschwülste des Tumors, die fernab der Brust auftreten. Sie bilden sich aus Krebszellen, die über die Blut- und Lymphgefäße ausgewandert sind und sich andernorts im Körper ansiedeln. Obwohl die Therapie von Anfang an darauf abzielt, auch losgelöste Tumorzellen zu treffen, entziehen sich einige manchmal dem Zugriff.
Am häufigsten treten Metastasen bei Brustkrebs in folgenden Organen auf:
Am Skelett sind in absteigender Häufigkeit betroffen:
- Wirbelkörper
- Oberschenkelknochen
- Becken
- Rippen
- Brustbein
- Schädeldach
- Oberarmknochen
Je nach Art und Ort einer Metastase können Beschwerden wie Knochenschmerzen und -brüche, Rückenschmerzen, Beschwerden im Oberbauch, Schmerzen beim Atmen, Atemnot, Sehstörungen, Kopfschmerzen oder Schwindel auftreten. Gewichtsverlust kann den Körper insgesamt schwächen.
Sind Metastasen aufgetreten, ist eine vollständige Heilung in aller Regel nicht mehr möglich. Aber in vielen Fällen kann die Erkrankung auch in dieser Situation durch verschiedene Therapien noch längere Zeit gut unter Kontrolle gehalten werden.
Die unterstützende Begleitung zielt dann auf eine Linderung oder Beseitigung von Symptomen, Verlängerung der Lebenszeit, Erhöhung der Lebensqualität und Vermeidung von Komplikationen ab. Dabei ist es wichtig, die Belastungen durch Nebenwirkungen der Therapie gegen den Vorteil für die weitere Prognose, ausreichende Lebensqualität und die Wünsche der Patientin abzuwägen.
Für die Behandlung von Metastasen ist zunächst die Lokalisation der Tochtergeschwülste durch bildgebende Verfahren notwendig. Es ist außerdem wichtig, die Gewebemerkmale einer Metastase zu bestimmen, da hier gegenüber dem Ersttumor Änderungen eingetreten sein können, insbesondere bei den Hormonrezeptoren und HER2.
Grundsätzlich werden metastasierte Erkrankungen meist systemisch, also etwa mittels Chemo-, Antihormon- und/oder zielgerichteter Therapie behandelt.
Einzelne Tochtergeschwülste, zum Beispiel in der Leber oder Lunge, können oft operativ entfernt werden. Nicht-operativ lassen Lebermetastasen sich auch durch eine sogenannte Radiofrequenzablation (RFA) ausschalten. Dabei werden unter Ultraschallkontrolle Elektroden in die Metastase eingebracht und diese unter Hochfrequenzstrom gesetzt. Die sich entwickelnde Hitze zerstört das Gewebe.
Einzelne beziehungsweise wenige Hirnmetastasen können operativ oder durch eine gezielte Strahlentherapie ("Radiochirurgie") behandelt werden. Zusätzlich kann das gesamte Gehirn bestrahlt werden. Letzteres ist auch bei Vorhandensein vieler Hirnmetastasen ein Weg. Ist die Grunderkrankung ein HER2-positiver Brustkrebs, so kann unter anderem eine Therapie mit dem Medikament Lapatinib, eventuell kombiniert mit Capecitabin infrage kommen.
Als medikamentöse Behandlung kann der Arzt oder die Ärztin je nach medizinischer Konstellation und dem Wunsch der Betroffenen entweder eine (erneute) Anti-Hormon- oder Chemotherapie und/oder eine zielgerichtete Therapie einleiten. Sie alle wirken auf den ganzen Körper, also systemisch. Welche Therapie individuell für eine Patientin infrage kommt, werden ihre behandelnden Ärzte und Ärztinnen mit ihr diskutieren.
Antihormonale Therapie bei Brustkrebs mit Fernmetastasen
Prinzipiell kommen bei Frauen nach den Wechseljahren als antihormonelle Therapie wie in der adjuvanten Therapie Tamoxifen und Aromatasehemmer in Betracht. Der Aromatasehemmer kann gegebenenfalls mit der zielgerichteten Substanz Everolimus oder CDK4/6-Hemmern kombiniert werden, um das Ansprechen zu verbessern. Eine weitere Möglichkeit in dieser Behandlungsphase ist der Östrogen-Antagonist Fulvestrant.
Frauen vor den Wechseljahren wird häufig eine Therapie mit Tamoxifen sowie die Unterbindung der Hormonbildung in den Eierstöcken empfohlen. Dies kann zum Beispiel mittels Medikamenten wie den sogenannten GnRH-Agonisten erfolgen. Später oder wenn Tamoxifen nicht vertragen wird, kann die Therapie auch auf einen Aromatasehemmer zusammen mit einer Unterdrückung der Eierstockfunktion (GnRH-Agonist) umgestellt werden.
Chemotherapie bei Brustkrebs mit Fernmetastasen
Als Chemotherapie wenden Ärzte in dieser Behandlungssituation meist einzelne Substanzen an (Monochemotherapie), um die Nebenwirkungen zu begrenzen. Sehr häufig kommen zum Beispiel einzelne Anthrazykline oder Taxane zum Einsatz, allerdings vor allem dann, wenn die Betroffenen damit noch nicht behandelt worden sind. Es gibt auch Alternativen. Eine Rolle spielt immer der allgemeine Zustand der Patientin, außerdem die Frage, an welcher Stelle die Metastasen sich befinden, ob sie Rezeptoren aufweisen und welche, außerdem der Krankheitsverlauf. Nimmt der Tumor schnell zu, kann sich auch eine kombinierte Chemotherapie (Polychemotherapie) mit verschiedenen Substanzen anbieten. Welche der Arzt oder die Ärztin hier vorschlägt, hängt ebenfalls von der Vorbehandlung ab.
Zielgerichtete Therapie bei Brustkrebs mit Fernmetastasen
Auch für die fortgeschrittene Phase einer Brustkrebserkrankung gibt es heute Medikamente, die das Tumorwachstum gezielt bremsen und so das Überleben verlängern können. Die Bezeichnung "zielgerichtete Therapien" leitet sich aus dem englischen Wort "target" (das Ziel) ab. Die Behandlung setzt an ganz bestimmten Strukturen in der Zelle (targets) an. Auch Metastasen können zum Beispiel HER2-Rezeptor-positiv sein. Wenn sich dieses Merkmal auf den Krebszellen findet, neigen sie dazu, sich schneller zu teilen und zu vermehren. Dann lässt sich gezielt eingreifen: Zusätzlich zur Chemotherapie wird eine gegen HER2 gerichtete Therapie eingesetzt.
Je nach Vorbehandlung und weiteren individuellen Voraussetzungen eignen sich im Rahmen der gezielten Therapie verschiedene Substanzen, darunter auch Kombinationen von Antikörpern und Chemotherapeutika. Wenn die Metastasen gleichzeitig Hormonrezeptoren aufweisen, kann ein Aromatasehemmer oder Fulvestrant dazukommen. Die zielgerichteten Medikamente entwickeln sich ständig weiter. Derzeit sind für die Behandlung von metastasiertem Brustkrebs in Deutschland zugelassen und eingeführt:
- Trastuzumab
- Pertuzumab
- T-DM1
- Lapatinib
- Bevacizumab
- Everolimus
- CDK4/6-Hemmer
- Atezolizumab
Trastuzumab
Einsatz bei HER2-positivem metastasierten Brustkrebs einschließlich hormonrezeptor-positiver Formen; Verabreichung als Infusion in die Blutbahn über einen sogenannten Portkatheter oder Port. Dabei handelt es sich um einen Zugang zum Venensystem, der länger liegen bleiben kann. Zusammen mit Trastuzumab wird ein Anti-Allergikum verabreicht. Auch die Gabe unter die Haut (subkutan) ist möglich. Zu den häufigeren Nebenwirkungen zählen unter anderem: allergische Reaktionen, grippeähnliche Symptome, Herzstolpern, Brustschmerzen, Schweratmigkeit, Kopfschmerzen, Durchfälle, Schwellungen im Gesicht, Nagelschäden.
Pertuzumab
In Kombination mit Trastuzumab und einem Taxan (vor allem Docetaxel), Infusion in die Blutbahn. Auch im Rahmen der neoadjuvanten Brustkrebstherapie empfohlen. Relativ häufige Nebenwirkungen sind zum Beispiel Durchfall, Atemwegsinfektionen, Störungen der Blutbildung mit Blutarmut und Abfall der weißen Blutkörperchen sowie Fieber, ferner Mundschleimhautentzündungen, Nagelveränderungen, Störungen der Herzfunktion, Müdigkeit.
T-DM1 (Trastuzumab-Emtansin)
Sogenanntes Antikörper-Wirkstoff-Konjugat für Frauen mit örtlich fortgeschrittenem oder metastasiertem, HER2-positivem Brustkrebs und wenn nach einer Behandlung vor der Operation der Tumor noch nicht weg ist. Das Präparat enthält den bereits erwähnten Antikörper Trastuzumab (T), an den über eine stabile Verbindung ein weiterer Wirkstoff (DM1 = Emtansin) angehängt wurde. DM1 ist ein Zytostatikum, das die Zellteilung hemmt. Der Antikörper Trastuzumab bewirkt eine zielgerichtete Anreicherung des Zytostatikums direkt im HER2-positiven Tumor. Auch hier können Nebenwirkungen auftreten: etwa Abfall der Blutplättchen (Thrombozytopenie), Anstieg Leberenzyme, Fieber, Kopfschmerzen, Husten, Nasenbluten. Das Antikörper-Wirkstoff-Konjugat gilt aber als verträglicher als eine konventionelle Chemotherapie.
Lapatinib
Lapatinib wird inzwischen seltener und insbesondere bei Hirnmetastasen eingesetzt, da es die Blut-Hirn-Schranke aufgrund seiner geringen Größe gut überwinden kann. Die Anwendung erfolgt in Tablettenform. Zu den Nebenwirkungen zählen zum Beispiel Durchfall, Übelkeit, Erbrechen, Hautausschlag, Blasenbildung und Rötung an Handflächen und Fußsohlen (Hand-Fuß-Syndrom), Störungen der Herzfunktion.
Bevacizumab
Findet Anwendung im metastasierten Stadium bei HER2-negativem Brustkrebs, insbesondere bei triple-negativer Erkrankung. Bevacizumab spielt keine große Rolle mehr in der Brustkrebsbehandlung. Infusion in die Blutbahn über einen Port. Nebenwirkungen können beispielsweise Bluthochdruck, Gelenkschmerzen, Fieber, Kopfschmerzen, Augenbeschwerden, verändertes Geschmacksempfinden sein.
Everolimus
Sogenannter mTOR-Kinase-Hemmer, der das Eiweiß mTOR hemmt; zugelassen für HER2-negative, Hormonrezeptor-positive fortgeschrittene Brustkrebsformen; Anwendung als Tabletten, zurzeit zugelassen in Kombination mit dem Aromatasehemmer Exemestan. Es kann zu Nebenwirkungen wie Atemwegsinfektionen, Blutarmut, Mundschleimhautentzündungen, Durchfall, Gewichtsverlust, Venenthrombosen, Herzschwäche, Nierenstörungen kommen.
Atezolizumab
Atezolizumab ist ein Antikörper, der quasi die körpereigene Immunabwehr auf den Tumor reaktiviert. Er eignet sich zur Erstbehandlung von fortgeschrittenem oder metastasiertem triple-negativem Brustkrebs, der das Eiweiß PD-L1 auf seiner Oberfläche trägt. Gegen dieses Eiweiß richtet sich der Antikörper.
Vorbeugung von Knochenbrüchen bei Skelettmetastasen und Schmerzlinderung
Liegen Metastasen im Skelett vor, so lässt sich durch die Einnahme von Bisphosphonaten oder einem sogenannten Rank-Ligand-Inhibitor wie Denosumab Knochenbrüchen vorbeugen. Knochenschmerzen können durch diese Behandlung auch zurückgehen. Zur Stabilisierung und Schmerzlinderung können an Metastasen erkrankte Skelettbereiche auch bestrahlt oder operativ versorgt werden. Dies gilt insbesondere bei einem drohenden Wirbelbruch, sonstigen metastasenbedingten Knochenbrüchen oder wenn die Gefahr der Rückenmarksquetschung durch eine instabile Wirbelsäule besteht.
Nachsorge bei Brustkrebs
Die Nachsorge zielt vor allem darauf ab, einen mögliche Rückfall in der Brust oder den benachbarten Lymphknoten rechtzeitig zu entdecken, da der Tumor, wenn er an der ursprünglichen Stelle wieder auftritt, sehr effektiv behandelt werden kann.
Zudem sollen mögliche Nebenwirkungen der Tumortherapie festgestellt und therapiert werden. Dabei geht es zum Beispiel um Probleme wie klimakterische Beschwerden, Osteoporose oder ein Lymphödem des Armes. Anzeichen eines Müdigkeitssyndroms sollten Sie nicht versuchen, wegzustecken, sondern beim Arzt ansprechen.
Außerdem können Rehabilitationsmaßnahmen und psychosoziale Hilfestellungen im Rahmen der Nachsorge vorangetrieben und koordiniert werden, sobald die Erstbehandlung abgeschlossen ist.
Abstand der Nachsorgeuntersuchungen
Die Kontrolluntersuchungen erfolgen in den ersten drei Jahren nach Abschluss der Brustkrebsbehandlung im Abstand von drei Monaten. Bis zum fünften Jahr finden die Kontrollen dann alle sechs Monate statt, danach jährlich.
Inhalt der Nachsorgeuntersuchungen
Die Nachsorge findet meist in der frauenärztlichen Praxis statt. Im Mittelpunkt der Termine steht das Gespräch mit dem Arzt oder der Ärztin, der oder die die Frau ausführlich nach ihrem körperlichen und seelischen Befinden fragt, und die körperliche Untersuchung. Zusätzlich kann der Frauenarzt oder die Frauenärztin regelmäßig einen Ultraschall der Brust machen und eine jährliche Mammografie veranlassen.
Weitere Diagnosemaßnahmen sind meistens besonderen Fragestellungen vorbehalten, etwa bei Verdacht auf einen Rückfall, Metastasen oder natürlich auch eine andere Erkrankung.
Wenn der Arzt oder die Ärztin bestimmte Untersuchungen anordnet, werden die Kosten dafür üblicherweise von den Krankenkassen übernommen.
Einmal pro Monat nach der Regelblutung, wenn das Gewebe weich und weniger durchblutet ist, sollten die Betroffenen an die Selbstuntersuchung der Brust denken.
Örtlicher Rückfall bei behandeltem Brustkrebs
Bei einem Teil der brusterhaltend behandelten Frauen tritt der Tumor innerhalb von zehn Jahren in der Brust, der Brustwand, ihrer Haut oder der Achselhöhle erneut auf. Das bezeichnet Mediziner als Lokalrezidiv oder lokoregionäres Rezidiv. Auch bei solchen örtlich begrenzten Rezidiven ist eine Heilung möglich. Wie lang das krankheitsfreie Zeitfenster gewesen ist, spielt eine Rolle für die Prognose: Je größer, desto besser stehen die Chancen.
Um zu prüfen, ob sich der Krebs auf andere Organe ausgebreitet hat, wird die Patientin zunächst nochmals genauer mit bildgebenden Verfahren wie einer Mammografie oder einem CT untersucht.
Operation bei einem Brustkrebsrückfall
Bei einem Rezidiv in der Brust muss diese abgenommen werden, falls die Brust schon bestrahlt wurde. Falls die betroffene Brust nicht bestrahlt wurde, ist auch der Erhalt der Brust möglich. Allerdings sehen Ärzte und Ärztinnen dieses Vorgehen nur in wenigen Fällen als empfehlenswert an, weil dann das Risiko für einen erneuten örtlichen Rückfall erhöht ist.
Bei einem Rückfall in der Achselhöhle wird diese operiert. Ziel ist immer, das Tumorgewebe komplett zu entfernen (R0-Resektion).
Das gilt genauso für einen Tumor, der nach Abnahme der Brust wiedergekehrt ist – sei es an der Brustwand, in der Achselhöhle oder im weiteren Umfeld, auch im Bereich von Narben: Er sollte nach Möglichkeit vollständig entfernt werden.
Bestrahlung bei einem Rezidiv
Eine zum zweiten Mal operierte Brust, eine Brustwand nach Entfernung der Brust oder ein erkranktes Lymphabflussgebiet der Brust werden – wenn möglich – erneut bestrahlt, eventuell mit einer Teilbrustbestrahlung.
Zusätzlich erhalten die Betroffenen in der Regel eine systemische Therapie, die an die (neo-)adjuvante Behandlung bei erstmalig auftretendem Brustkrebs angelehnt ist.
Anti-hormonelle Therapie bei Brustkrebs-Rezidiv
Der Pathologe oder die Pathologin nimmt jeweils ein Grading und eine Rezeptoren-Bestimmung (Hormon- und HER2-Rezeptoren) der Tumorzellen vor. Bei Hormonempfindlichkeit des Gewebes kann erneut eine Hormontherapie erfolgen oder aber der Arzt oder die Ärztin stellt eine laufende Hormontherapie um.
Chemotherapie bei einem Rezidiv
Anhand der individuellen Situation der Patientin prüft er außerdem, ob nach der Rezidiv-Operation auch eine Chemotherapie erfolgen sollte. Das kommt zum Beispiel für Patientinnen mit einem erhöhten Risiko infrage, etwa in jungem Alter oder wenn bestimmte Tumormerkmale wie Hormonrezeptor-Negativität vorliegen. Bei der Entscheidung müssen allerdings Vortherapien berücksichtigt werden.
Zielgerichtete Antikörper-Therapie bei einem Brustkrebsrückfall
Ist der Tumor HER2-positiv, kann zusätzlich eine gegen HER2 gerichtete Therapie, zum Beispiel mit dem Antikörper Trastuzumab eingesetzt werden, insbesondere dann, wenn die Betroffene früher noch nicht damit behandelt worden ist.
Ursachen und Risikofaktoren für Brustkrebs
Hormonelle Einflüsse auf die Brustkrebsentstehung
Weibliche Geschlechtshormone – Östrogene und Gestagene – spielen bei Brustkrebs eine Rolle. Dass die Hormonspiegel während eines jeden Menstruationszyklus schwanken und die Struktur der Brustdrüse beeinflussen, ist zunächst einmal ganz normal.
Noch nachhaltiger verändern eine Schwangerschaft und die Wechseljahre das Brustgewebe (siehe Kapitel "Aufbau der Brust ..."). Vereinfacht gesagt üben die weiblichen Hormone einen Wachstumsreiz auf die Drüsenzellen aus. Dabei sind neben den natürlichen, körpereigenen Hormonen auch "von außen" zugeführten Hormone, zum Beispiel bei einer Hormontherapie in den Wechseljahren relevant.
Schwangerschaften mit anschließenden Stillperioden können das Brustkrebsrisiko senken – je jünger die Betroffene zum Zeitpunkt der Schwangerschaften und des Stillens ist, umso besser. Günstig: eine Gesamtstilldauer von mehr als eineinhalb bis zwei Jahren.
Einen eher ungünstigen Einfluss auf das Brustkrebsrisiko haben:
- Lange Zeitspanne zwischen der ersten und letzten Regelblutung (Menarche und Menopause): Je früher die Regelblutung einsetzt und je später die Wechseljahre beginnen, desto länger ist die Brust hormonellen Einflüssen ausgesetzt. Dieser Umstand gilt als Faktor, der das Brustkrebsrisiko steigert.
- Hormontherapie gegen Wechseljahresbeschwerden: Sie erhöht die Gefahr von Brustkrebs und Eierstockkrebs leicht. Dies betrifft vor allem die kombinierte Behandlung mit Östrogenen und Gestagenen bei längerer Einnahme. Nach Beendigung der Hormontherapie sinkt das Risiko wieder. Bei gesunden Frauen, die ausgeprägte Beschwerden wie etwa starke Hitzewallungen haben, halten Gynäkologen und Gynäkolginnen eine zeitlich begrenzte, niedrig dosierte Hormonersatztherapie für vertretbar.
- Antibabypille & Co: Die hormonelle Empfängnisverhütung, etwa in Form der Antibabypille oder kurz Pille, steigert das Brustkrebsrisiko nicht dauerhaft. Zugleich senkt die Pille das Risiko für andere Krebsarten, zum Beispiel Gebärmutterschleimhaut- und Eierstockkrebs.
- Pflanzliche Stoffe gegen Wechseljahresbeschwerden: Nahrungsergänzungsmittel mit sogenannten Soja-Isoflavonen zum Beispiel können in höheren Dosen östrogenähnlich wirken. Daher auch der Name Phytoöstrogene. Grundsätzlich könnten Phytoöstrogene das Brustkrebsrisiko günstig oder auch gar nicht beeinflussen. Die genaue Wirkung von Phytoöstrogenen oder Mischungen von Phytoöstrogenen ist aber in vielen Fällen noch nicht ausreichend gut untersucht. Lassen Sie sich vor der Einnahme sicherheitshalber von Ihrem Frauenarzt oder ihrer -ärztin beraten, insbesondere bei hormonabhängigem Brustkrebs. Wer sich ausgewogen ernährt und dabei gelegentlich auch natürliche sojahaltige Nahrungsmittel verzehrt, schadet seiner Gesundheit sicherlich nicht.
Präparate, die Traubensilberkerzenextrakt enthalten, erhöhen das Brustkrebsrisiko nicht. Allerdings können sie eventuell mit verabreichten Medikamenten wechselwirken. Sprechen Sie auch hier auf jeden Fall mit Ihrem Gynäkologen oder ihrer Gynäkologin, bevor Sie solche und andere pflanzliche Mittel anwenden, insbesondere auch während einer Brustkrebstherapie.
Einfluss des Lebensstils
Bestimmte Risikofaktoren für Brustkrebs hängen mit den allgemeinen Lebensumständen zusammen und lassen sich folglich mehr oder weniger beeinflussen. Dazu zählen:
- Bewegungsmangel und Übergewicht nach den Wechseljahren: Dass sie das Brustkrebsrisiko steigern können, ließ sich insbesondere während und nach den Wechseljahren beobachten. Offenbar spielt hier eine unausgeglichene Stoffwechsellage, die auch ganz allgemein gesundheitsschädlich ist, eine Rolle.
- häufiger Konsum von Alkohol: Das Risiko steigt mit der Menge. Schon ab 18 Gramm Alkohol täglich (das entspricht zum Beispiel einem Glas mit zirka 150 Milliliter Wein, Alkoholgehalt 13 Vol.-%) nimmt es deutlich zu. Daher: Nicht mehr als 10 Gramm Alkohol täglich zu sich nehmen.
- Rauchen und Passivrauchen kann das Risiko für Brustkrebs erhöhen.
Risikofaktor Alter
Neben der genetischen Veranlagung ist das Alter der wichtigste Risikofaktor für Brustkrebs. Mit steigendem Alter nimmt das Brustkrebsrisiko zu. Zwischen 65 und 70 ist es am höchsten.
Risikofaktor Gutartige Veränderungen der Brustdrüse
Bestimmte Veränderungen der Brusdrüse gehen mit einem erhöhten Risiko für Brustkrebs einher. Das ist auch der Fall, wenn die Brustdrüse in der Mammographie besonders dicht ist.
Genetische Veranlagung
In etwa fünf bis zehn Prozent der Fälle liegt der Veranlagung zu Brustkrebs die Veränderung eines einzelnen Gens zugrunde (Brustkrebsgene oder Hochrisikogene). Sehr viel häufiger wirken jedoch verschiedene Faktoren, auch genetische, zusammen. In der Summe tragen sie dann dazu bei, dass sich grundlegende Änderungen ins Erbgut einer Zelle einschleichen und es zur Entartung des Brustgewebes kommt.
Wenn entsprechende genetische Veränderungen bei jemandem vorliegen, kommt es leichter dazu, dass Krebs entsteht. Anders gesagt: Die Betroffenen reagieren empfindlicher auf weitere Risikofaktoren wie Bewegungsmangel, Übergewicht oder erhöhten Alkoholkonsum als Menschen mit "normaler" Genausstattung.
Brustkrebsgene - es gibt nicht nur BRCA1 und BRCA2
Mitte der Neunziger Jahre wurden zwei Brustkrebsgene, nämlich BRCA1 und BRCA2 entdeckt, die in erblich mit Brustkrebs belasteten Familien häufig verändert sind.
BRCA steht für "Breast Cancer", also Brustkrebs. Die verantwortlichen Genveränderungen werden über die Eizelle oder Samenzelle, also von Mutter und Vater, vererbt und finden sich in allen Körperzellen wieder. Wenn eine Frau ein solches verändertes Gen besitzt, hat sie ein hohes Risiko, im Verlauf ihres Lebens an Brustkrebs zu erkranken. Auch das Risiko, dass eine Brustkrebspatientin erneut an Brustkrebs erkrankt, ist dann erhöht, ebenso das Risiko für Eierstockkrebs. Es gibt zudem Hinweise, dass in Familien mit familiärem Brustkrebs auch einige andere Krebserkrankungen etwas häufiger auftreten.
Eine Veränderung der BRCA-Gene besteht aber nur bei etwa einem Viertel aller von genetisch bedingtem Brustkrebs Betroffenen. Bei anderen Betroffenen können andere Gene eine Rolle spielen.
Entdeckt wurde zum Beispiel inzwischen das Risiko-Gen RAD51C, manchmal auch als BRCA3 bezeichnet. Veränderungen dieses Gens können ebenfalls erblichen Brust- und Eierstockkrebs auslösen. Zwei weitere Risikogene sind PALB-2 und CHEK2. Insgesamt kennt man heute viele unterschiedliche Gene, deren Veränderungen sich auf das Brustkrebsrisiko auswirken.
Was tun bei Verdacht auf familiären Brustkrebs?
Frauen, in deren Familien Brustkrebs häufiger auftritt, sind zu Recht besorgt und möchten wissen, was sie vorbeugend tun können.
Wenn bei einer Frau der Verdacht auf eine erbliche Belastung besteht, kann sie sich an ein spezialisiertes humangenetisches Zentrum beziehungsweise an eines der universitären Zentren "Familiärer Brust- und Eierstockkrebs" wenden und einen genetische Untersuchung machen lassen. Sie kann sich auch von ihrem Gynäkologen oder ihrer Gynäkologin beraten lassen, welche Anlaufstelle geeignet ist.
Vor dem Test erfolgt an dem Zentrum immer erst eine Stammbaumanalyse sowie eine medizinische und psychologische Beratung. Danach besteht genügend Zeit, sich mit der Thematik auseinanderzusetzen und die eigene Entscheidung für oder gegen den Test gut begründet zu treffen.
Wann ist eine genetische Untersuchung ratsam?
Vom Frauenarzt oder der Frauenärztin kann man sich dazu beraten lassen, bei welchen familiären Konstellationen eine genetische Untersuchung oder eine Beratung in einem entsprechenden Zentrum sinnvoll ist. Beispielsweise ist dies nach Einschätzung von Experten der Fall wenn in der Familie:
- mindestens drei Frauen an Brustkrebs erkrankt sind
- bei zwei Frauen Brustkrebs vorliegt oder lag, wobei eine davon bei Erkrankung jünger als 51 Jahre ist
- zwei Frauen an Eierstockkrebs erkrankt sind
- eine Frau an Brust- und eine an Eierstockkrebs leidet oder litt
- eine Frau mit 35 Jahren oder jünger an Brustkrebs erkrankt ist
- bei einer Frau unter 50 Jahren beidseitiger Brustkrebs festgestellt wurde
- ein Mann an Brustkrebs und eine Frau an Brust- oder Eierstockkrebs erkrankt ist
Was sagt die genetische Untersuchung aus?
Der Test kann bei gehäuftem Vorkommen von Brustkrebs in einer Familie Klarheit darüber schaffen, ob bei der getesteten Person eines der bekannten Risikogene für Brustkrebs verändert ist. Lässt sich zum Beispiel eines der Gene BRCA1 oder BRCA2 nachweisen, bedeutet das, dass die betroffene Frau ein erhöhtes Risiko hat, an Brust- und Eierstockkrebs zu erkranken. Im Vergleich zu Frauen ohne diese Gene, erkrankten Personen mit den Genen BRCA1 und BRCA2 auch 20 Jahre früher an Brustkrebs. Frauen mit einer entsprechenden genetischen Veranlagung werden individuell auf sie angepasste Früherkennungsuntersuchungen und -programme vorgeschlagen. Auch eine vorbeugende Entfernung der Brust und/oder der Eierstöcke kann erwogen werden. Bei einem entsprechenden Testergebnis beraten die Zentren dazu.
Früherkennungsprogramme für Frauen mit Brustkrebsgenen
Für Frauen mit einer BRCA1-/-2-Mutation gibt es ein von verschiedenen Krankenkassen und privaten Krankenversicherungen finanziertes, an die spezialisierten Zentren "Familiärer Brust- und Eierstockkrebs" gebundenes Programm zur intensivierten Früherkennung von Brustkrebs. Ein intensiviertes Früherkennungs-Programm kann übrigens auch ohne Genanalyse empfohlen werden, wenn die Stammbaumanalyse für eine Hochrisikosituation spricht.
Das sieht das Programm zur intensivierten Brustkrebsfrüherkennung bei nachgewiesener Hochrisiko-Mutation vor:
- Ab dem 25. Lebensjahr beziehungsweise fünf Jahre vor dem jüngsten Erkrankungsalter in der Familie alle sechs Monate ärztliche Tastuntersuchungen und Sonografien sowie jährliche kontrastmittelverstärkte Magnetresonanztomografien der Brust.
- Ab dem 40. Lebensjahr kommen alle ein bis zwei Jahre Mammografien hinzu.
Frauen ohne nachgewiesene BRCA-Mutation (siehe oben), die aufgrund anderer genetischer Konstellationen ein erhöhtes Lebenszeit-Brustkrebsrisiko (über 30 Prozent) haben, werden an ihr individuelles Risiko angepasste Früherkennungsmaßnahmen angeboten. Ab 50 Jahren stehen den Betroffenen dann die üblichen Früherkennungsmaßnahmen (das "Screening") zur Verfügung.
Vorbeugende Operationen bei einer BRCA-Mutation
Bei einem positiven BRCA-Test kommen vorbeugende Operationen in Betracht. Damit lässt sich das Krebsrisiko nachhaltig senken.
Eine vorbeugende Entfernung der Eierstöcke und Eileiter empfehlen Ärztinnen und Ärzte gesunden BRCA-1Mutationsträgerinnen um das 35ste, BRCA-2-Mutationsträgerinnen um das 40. Lebensjahr beziehungsweise nach abgeschlossener Familienplanung – zusätzlich zur intensivierten Früherkennung. Jedenfalls sollte die vorbeugende Entfernung fünf Jahre früher erfolgen als das jüngste Familienmitglied erkrankte. Die Maßnahme bringt einen doppelten Nutzen mit sich: Das Risiko für Eierstockkrebs sinkt ebenso wie das Risiko an dieser Krankheit zu versterben. Gegen vorzeitig einsetzende Wechseljahresbeschwerden als Folge des Eingriffs kann bis zum Alter von ungefähr 50 Jahren eine niedrig dosierte Hormonersatztherapie angewandt werden.
Eine beidseitige Entfernung der Brustdrüse kann das Risiko für Brustkrebs bis auf ein sehr geringes Restrisiko senken. Die Brust kann nach der Operation wieder neu aufgebaut werden. Es existieren verschiedene Verfahren mit unterschiedlichen Vor- und Nachteilen.
Dass insbesondere die Brustamputation – trotz der Option des Brustwiederaufbaus – als entstellend wahrgenommen werden kann und daher bei einigen Frauen auf Ablehnung stößt, überrascht nicht. Es gibt aber Frauen, die bei einer Brustkrebs-Hochrisikosituation auf größtmögliche Sicherheit setzen möchten und die Belastungen auf sich nehmen.
Die Entscheidung über den eigenen Weg wird keiner Betroffenen leicht fallen. Sie kann auch hier auf kompetente medizinische und psychologische Beratung in dem ihr bereits bekannten Zentrum für "Familiären Brust- und Eierstockkrebs" zurückgreifen.
Methoden zur Früherkennung von Brustkrebs
Die Brüste regelmäßig selbst untersuchen
Es schadet nicht, einmal im Monat zum selben Zeitpunkt die Brüste selbst abzutasten. Vor den Wechseljahren sollte das am besten in den ersten zehn Tagen des Zyklus, also an den Tagen nach der Regelblutung stattfinden.
Die Selbstuntersuchung hat vor allem den Vorteil, ein Gefühl für die Beschaffenheit der Brust zu entwickeln und Auffälligkeiten bewusster wahrzunehmen. Wie das am besten geht, kann man sich vom Arzt oder der Ärztin bei der Früherkennungsuntersuchung zeigen lassen und danach zu Hause in Ruhe nachvollziehen.
Ab 30: Brustkrebs-Früherkennung in der gynäkologischen Praxis
Die gesetzlich verankerte Krebsfrüherkennungsuntersuchung der Brust richtet sich an Frauen ab 30. Der Arzt oder die Ärztin untersucht beide Brüste. Dabei nimmt die Frau am besten verschiedene Körperhaltungen ein: Stehen, Sitzen, Arme in die Hüften gestemmt, über den Kopf gehoben.
Außerdem begutachtet er oder sie die Lymphabflusswege und tastet sie ab: die Achselhöhlen und die Bereiche über und unter dem Schlüsselbein. Bei auffälligen Tastbefunden in der zweiten Zyklushälfte sollte in der ersten Hälfte des nächsten Zyklus eine Kontrolle stattfinden.
Der Frauenarzt oder die Ärztin notiert sich auch die wichtigen Punkte der individuellen Familien- und Krankengeschichte und Angaben über eingenommene Medikamente.
Bei der Mammografie wird die Brust geröntgt.
© Shutterstock / Gorodenkoff
Ab 50 Jahren: Mammografie-Screening
Für 50- bis 69-jährige Frauen steht derzeit zusätzlich alle zwei Jahre die freiwillige Röntgen-Reihenuntersuchung der Brust zur Verfügung, das Mammografie-Screening.
Bei der Mammografie wird die Brust von zwei Platten gehalten und zusammengepresst, damit sie möglichst flach ist, und anschließend von Röntgenstrahlung durchleuchtet – ein etwas unangenehmer und manchmal auch schmerzhafter, aber kurzer Moment. Jede Brust wird in zwei Richtungen abgebildet.
Da das Brustdrüsengewebe bei jüngeren Frauen strahlenempfindlicher und -dichter ist, beginnen die Screening-Mammografien erst im Alter von 50 Jahren.
Frauen der genannten Altersgruppe erhalten alle zwei Jahre eine Einladung zur Mammografie in einer qualifizierten Mammografie-Einheit. Eine oder mehrere solcher Einheiten bilden zusammen mit Einheiten zur Abklärungsdiagnostik eine sogenannte zertifizierte Screening-Einheit. In Deutschland gibt es davon zurzeit über 90 mit insgesamt rund 400 Standorten.
Die Aufnahmen der Brust werden von mindestens zwei erfahrenen Fachärzten oder -ärztinnen unabhängig voneinander ausgewertet (Doppelbefundung). Die beteiligten Ärztinnen und Ärzte befunden unter anderem pro Jahr Mammografien von mindestens 5000 Frauen. Das Ergebnis folgt schriftlich nach etwa sieben Werktagen.
Bei einem verdächtigen oder unklaren Befund erhält die Betroffene nochmals eine Einladung. Die Situation wird dann genau mit der Frau besprochen und zum Beispiel anhand einer Ultraschalluntersuchung abgeklärt. Manchmal schließt sich noch eine gezielte Vergrößerungs-Mammografie an. Möglicherweise ergibt sich auch die Empfehlung, eine Gewebeprobe aus der Brust zu entnehmen (mehr dazu jeweils im Kapitel "Diagnose").
Die Betroffene kann sich über die vorgeschlagenen Abklärungsuntersuchungen jederzeit mit dem Arzt ihres Vertrauens, der auf Wunsch mit informiert wird, abstimmen. Die Untersuchungen zur Abklärung von verdächtigen Mammografie-Befunden können in der Screening-Einheit oder an anderer qualifizierter Stelle nach Rücksprache mit der Screening-Einheit durchgeführt werden.
Frauen mit einem stark erhöhten Brustkrebsrisiko können bereits vor dem 50. Lebensjahr an einem gesonderten Screening-Programm teilnehmen.
Vorteile des Mammografie-Screenings
Das Screening soll eventuell vorhandene Tumoren schon möglichst früh erkennen. Denn dann ist Brustkrebs üblicherweise sehr gut zu behandeln und die Chancen auf eine dauerhafte Heilung sind hoch. Das Screening schützt aber natürlich nicht davor, dass Brustkrebs überhaupt entsteht.
Daten aus dem Jahr 2016 ergaben: Bei etwa sechs von 1000 teilnehmenden Frauen wurde ein Brustkrebs durch die Früherkennungsmammografie entdeckt. Vor der Einführung des Programms waren es jedes Jahr zwei bis drei Frauen von 1000 bei denen ein Brustkrebs diagnostiziert wurde. Rund 80 Prozent der Tumoren werden heute in einem frühen Stadium erkannt. Vor dem Screening waren es 49 Prozent.
Anders gesagt: Inzwischen konnte eine Halbierung des Anteils größerer Tumoren bei den Teilnehmerinnen verzeichnet werden. Diskutiert wird allerdings, dass das vor allem daran liegt, dass auch kleine, wenig aggressive Tumoren gefunden wurden, die überhaupt nie auffällig geworden wären.
Bei den außerdem immer häufiger entdeckten Brustkrebsvorstufen, etwa das duktale Carcinoma in situ (DCIS), handelt es sich mitunter um solche, die sich später zu einem invasiven, also zerstörerisch in das umgebende Gewebe wachsenden Brustkrebs entwickeln.
Dass das Brustkrebs-Screening Leben retten kann, gilt als erwiesen. Man geht davon aus, dass etwa zwei bis sechs von 1000 Frauen, die über 20 Jahre regelmäßig am Screening teilnehmen, durch die frühzeitige Erkennung ihres Brustkrebses geheilt werden können.
Schlechter bezifferbar, aber sicherlich auch zu beachten ist der Vorteil, der den betroffenen Frauen entsteht, die durch das frühe Auffinden ihres Tumors eine weniger belastende Therapie erhalten können.
Nachteile des Mammografie-Screenings
Es ist möglich, dass im Screening ein Brustkrebs entdeckt und behandelt wird, der der Frau nie Probleme gemacht hätte (sogenannte Überdiagnose). Die Häufigkeit der Überdiagnosen wird sehr kontrovers diskutiert. Nach Aussage des deutschen Insituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) erhalten neun bis zwölf von 1.000 Frauen, die über 20 Jahre am Screening teilnehmen, eine Überdiagnose. Dazu kommt, dass bei einigen Frauen Abklärungsuntersuchungen notwendig werden, die die Betroffenen körperlich und seelisch belasten können.
Wie bei jeder bildgebenden Untersuchung können sich zu einem kleineren Teil falsch-negative (fälschlicherweise unauffällige) Befunde ergeben, die die betreffende Frau fälschlich in Sicherheit wiegen.
Im Zuge des Screenings ist die Frau einer vermehrten Strahlenbelastung ausgesetzt. Jedoch ist diese dank moderner digitaler Technik relativ gering und wird im Vergleich zum Verzicht auf die Untersuchung von der Mehrheit der Experten und Expertinnen derzeit als weniger riskant angesehen.
Fazit: Jede Frau sollte abwägen, ob sie am Mammografie-Screening teilnehmen möchte. Sie sollte sich genau vom Arzt oder der Ärztin beraten lassen, eingehend selbst informieren und dann ihre Wahl treffen. Ihre Entscheidung kann sie immer wieder überdenken. Weitere Informationen zum Thema gibt der betreuende Frauenarzt oder die betreuende Frauenärztin oder auch der Krebsinformationsdienst.
Früherkennung mit Ultraschall oder MRT
In besonderen Fällen kann auch ein Ultraschall der Brust oder aber eine Magnetresonanztomografie (MRT) zur Früherkennung von Brustkrebs angezeigt sein. Ein Ultraschall kann zum Beispiel bei Frauen mit einem unklaren Befund in der Mammografie das Screening ergänzen. Als Früherkennungsuntersuchung wird die Ultraschalluntersuchung außerdem bereits in jungen Jahren im Rahmen der intensivierten Brustkrebs-Früherkennung eingesetzt, die Frauen mit BRCA1- oder BRCA2-Mutation angeboten wird. Auch MRT-Untersuchungen sind Bestandteil dieses Früherkennungsprogramms. Ab circa 40 Jahren werden diese Untersuchungen durch eine ein- bis zweijährliche Mammografie ergänzt. Bei Frauen mit berechnet hohem Risiko, aber ohne nachgewiesene Hochrisiko-Mutation, kann gegebenenfalls auch ein intensiviertes Nachsorge-Schema infrage kommen.
Brustkrebs und Schwangerschaft
Brustkrebs ist für jede Frau eine bedrohliche und enorm belastende Diagnose. Umso mehr, wenn die erschreckende Nachricht in die Zeit der Schwangerschaft fällt.
Doch auch hier kann die Krankheit bekämpft werden – und das, ohne dem Kind zu schaden. Die Behandlung kann in Ruhe geplant werden, wenn die Diagnostik erfolgt ist. Sie gestaltet sich ähnlich wie bei nicht schwangeren Frauen.
Operation und eine Chemotherapie sind in der Schwangerschaft möglich, wobei die Chemotherapie im zweiten und dritten Schwangerschaftsdrittel stattfinden kann.
Eine eventuell notwendige Bestrahlung oder Hormon- und Antikörper-Therapie wird auf einen Zeitpunkt ab zwei bis drei Wochen nach der Entbindung verlegt. Diese sollte erfolgen, wenn das Ungeborene eine ausreichende Reife erlangt hat. Zwischen einer Chemotherapie und der Entbindung sollten mindestens drei Wochen liegen. Vier Wochen nach Abschluss der Krebsbehandlung kann eine Frau ihr Kind stillen.
Hormonelle Empfängnisverhütung nach Erstbehandlung von Brustkrebs gilt als riskant. Es gibt alternative Verfahren, zum Beispiel Einlegen einer Kupferspirale in die Gebärmutter. Allerdings kann die Fruchtbarkeit nach der Chemotherapie auch beeinträchtigt sein.
Beratende Brustkrebs-Expertin

Unsere Expertin: Dr. Kathrin Stewen
© Pressebild Universitätsmedizin Mainz
Sie ist zertifizierter „senior breast surgeon“ und hat die stellvertretende Leitung des familiären Brust- und Eierstockkrebszentrums der Uniklinik Mainz inne.
Quellen:
- [1] Zentrum für Krebsregisterdaten: Brustkrebs (Mammakarzinom), ICD-10 C50. https://www.krebsdaten.de/... (Abgerufen am 29.07.2022)
- [2] Deutsche Gesellschaft für Ernährung: 10 Regeln der DGE. https://www.dge.de/... (Abgerufen am 02.09.2022)